-
MDMA-assisted therapy
2021年05月18日
・先日取り上げたpsilocybinに引き続き、催幻覚作用のある薬剤の臨床試験の報告になります。
・アンフェタミン誘導体であるMDMAを補助的に用いた心理療法が効果的そうだという話は1980年頃からあったようですが(Am J Psychother 40:393–404)、1985年にアメリカの物質規制法におけるスケジュール1(先のLSDやシロシビン、大麻などと同じ分類)に分類され、あらゆる状況においても使用する事が禁止されてからは、しばらくは臨床場面から消えていました。1990年半ばからは低用量での臨床試験が再開されています。
・今回PTSDにおける心理療法の補助としてMDMAが使用された第3相試験の結果が報告(文献1)されたのでみてみます。持続エクスポージャーにおけるトラウマ的記憶の処理がMDMAによりうまくいきやすくなる、ということのようです。
・Nature Medicine誌のイントロでは、MDMAはセロトニントランスポーターに結合してセロトニン放出を増やすとのみ書いてあり、それだとSSRIと同じじゃないかということになるので、文献2を用いてその薬理学的作用機序について少し調べておきます。
・そこまで詳しくは書いていなかったのですが、MDMAは主にセロトニン、ドーパミン、ノルエピネフリンを、再取り込みトランスポーターへの作用を介して生理的作用のあるレベルまで放出させ、オキシトシン,バソプレシン,コルチゾールなどのホルモンの分泌を促進するとありました。モデルマウスではMDMAは所属行動や向社会的行動を引き起こす可能性があり、マウスの社会的報酬に対する感受性を修飾することがあるとのことです。社会的行動の増加についてはどのセロトニン受容体を介したものかまではよくわかっていないとのことでした。
・MDMAは2011年からPTSDに対する補助治療として臨床試験が開始されており、6件の治療抵抗性PTSDに対する第2相試験のpooled analysisの結果(Psychopharmacology (Berl) 236:2735–2745)が良好であったことから、2019年にFDAはPTSDに対するMDMAの補助療法をbreakthrough therapyに指定しています
重度PTSDにおけるMDMA補助療法
背景
・PTSDの予後に影響しうる要因として、小児期のトラウマ、アルコールなどの物質使用障害の合併、うつ病、希死念慮、解離などの合併が報告されている・パロキセチンとセルトラリンはFDAにより承認されているPTSDに対する薬物療法の第1選択であるが、約40-60%の患者は反応しないといわれている
・持続エクスポージャーや認知行動療法などのトラウマ焦点化心理療法はPTSDの標準治療であるが、多くが反応しなかったり、脱落率が高いなどの問題もあり、費用対効果に優れた新規治療法が希求されている
・MDMAはシナプス前のセロトニントランスポーターに結合し、セロトニン放出を促進する。MDMAは動物モデルにおいて記憶消去や、おそらくはオキシトシンを介したメカニズムにより恐怖記憶の再固定化に影響を与えることがわかっており、社会的行動を活性化したことが報告されている。
・MDMAにより補助されたPTSD治療の6つの第2相試験のpooled analysisの結果は、安全性と有効性に関して確かな所見を報告している
・今回MDMA3回投与による重度PTSDに対するMDMA補助治療の有効性に関する第3相試験が行われた
対象と方法
・PTSD患者90名(DSM-5)。症状持続期間6カ月以上。ベースラインのCAPS-5で35点以上
・精神病性障害、双極I型障害、解離性同一性障害、精神病症状を伴う大うつ病、パーソナリティ障害、アルコールないし物質使用障害の合併などは除外
・平均年齢41歳。ベースラインのCAPS-5総得点平均44.1点
・平均罹病期間 14.1年。MDMA群の6名、プラセボ群の13名が解離のサブタイプあった
・大うつ病の合併は全体の91.1%
・これまでにMDMAの使用歴があるものは、32.2%(MDMD群 39.1%、プラセボ群 25.0%)、最近10年以内にMDMA使用歴があるのは21.1%(MDMA群 19.6%、プラセボ群 22.7%)
・トラウマの種類は戦争によるものは全体の12.2%(MDMA群 13.0%、プラセボ群 11.4%)、発達性トラウマ(developmental traum)が84.4%と大半
・主要評価項目は18週間でのCAPS-5の変化量
・MDAD群 n=46
・プラセボ n=44マニュアルを用いた治療的介入(http://maps.org/treatment-manual).
・参加者はセラピストから90分×3回の予備的セッションを受けた。予備的セッションでは治療同盟と信頼関係の確立に重点を置かれ、治療中に生じうる記憶や感情にどう対応するかについても指導された
・治療期間は8時間×3回の実験的セッションから構成された(各セッションは4週間の間隔で実施)。1回目の実験的セッションでは、MDMA投与群は80mgのMDMAを投与され、さらに忍容性に問題がなければ投与1.5時間~2.5時間後にMDMA 40mg追加投与をされた。
・2回目、3回目の実験的セッションではMDMA 120mgが投与され、さらに忍容性に問題がなければ投与1.5時間~2.5時間後にMDMA 60mgが追加投与された。追加投与されなかったのは全体の2.3%であった
・MDMAによる補助療法のためにマニュアル化された心理療法が各実験的セッションにおいて訓練を受けたセラピストにより提供された
・MDMAを用いた治療の全体的な目標は、PTSDの症状を軽減し、被検者の全体的な機能、幸福感、生活の質を向上させること。
・被検者はトラウマに関する記憶や思考、感情を自然に表出し、セラピストはトラウマ体験やそれに起因する思考、感情、行動に関する問題を処理することをサポートする。時にはセラピストが黙って共感的に傾聴することで問題の処理が達成されることもあるが、被検者が感情的にあるいは身体的に表出することが阻害される状況になり、トラウマに関連した記憶やその他の痛みを伴う記憶、思考、感情を処理するのが困難な場合には、セラピストはより積極的なサポートを行う。
・セラピストは被検者がトラウマ的な出来事の記憶を処理して、感情的な問題の解決とその出来事の意味についての新しい視点に到達することを補助する。また、他の人生経験についても、新たな視点を模索し、検証していく。
・セラピストは、被検者がトラウマを処理する過程に共感を持って立ち会い、同時に、健全で適切な境界線を維持する。そうすることで、セラピストは被検者が自分の内なる体験に寄り添うことを促し、癒しの過程で生じる可能性のある新しい、そして予期せぬ知覚を探求する意欲を育む安全な環境を作る。セラピー体験の強さは、セラピストが激しい感情をどれだけ快適に受け入れられるか、そして共感的に存在し、さまざまな感情的体験を受け入れることができるかどうかに大きく左右される
・セラピストは被検者自身が癒しの源であるという意識を育む。セラピストは被検者自身が内的体験に焦点をあてることと、そのことが安全な空間で行われていることを保証するため、沈黙と対話のバランスをうまくとる必要がある
・被検者が袋小路に入ったようなとき、防衛的な回避と思われる会話の後、あるいは感情的な問題が発生したときなど、MDMAの効果が強く出ている間に、より深い自己探求の機会を得ることができる
・MDMAを用いた心理療法では、重要な洞察や癒しが、予期せぬ方法で変化したり解決したりしうる。生じるものはすべて癒しの過程の一部と見なされる。被検者は可能な限り完全にプロセスに身をゆだねることを促される。
・セラピストの役割は、被検者が予想外の新しい認識や気づきを得られるように、指示するのではなく、しばしば被検者の発想に従うこととなる。また、被検者がつらい経験に直面することは、実際には癒しへの道であることをセラピストが思い出させることも有用である
・セラピストは、被検者が動揺し、圧倒されそうな思考、記憶、感情に直面しているとき、必要に応じて言葉など安心感を与える。ただしただし、被検者のプロセスを不必要に中断したり、被検者自身の内的治癒能力に対する信頼の欠如を伝えたりしないようにする
・セラピストは、一方では、癒しのプロセスが自然に展開するように経験を直視し、さらに増幅させ、他方では、過去の経験や痛みを伴う感情を明確にし、理解し、新たな視点を得ることを促す。
・MDMAの特質の一つは、記憶と向き合い、圧倒されることなく、実際に記憶や辛い感情を、再トラウマになるのではなく、癒すような形で処理することを容易にすることである
・MDMAは他人との親密感や親近感を高め、感情的に脅威となるものに直面したときの恐怖を軽減することについても被検者に説明する
・MDMAの主観的・生理的効果は、経口投与後30~75分で現れる。これらには、感覚の高まりや、視覚の歪みを含む知覚の変化、部屋の明るさや色の変化、音の質や見かけの位置の変化、時間の知覚の変化(特に遅くなる)、知覚、思考、記憶の意味や重要性の変化などが含まれる。MDMAの効果のピークは投与後70~90分で発生し、1~3時間持続する
・MDMAを摂取してから約15分以内に、被検者は布団にリクライニングし、快適であればアイシェードやヘッドフォンを使用し、セッションのために選択された音楽に合わせてリラックスすることが推奨される。セラピストは、被検者に、何が起ころうとも心を開いて、自分が本来持っている癒しの能力を信頼し、必要なものは何でも求めるように声をかける
・セッションが進むにつれて、被検者はポジティブな気分になり、自己と他者の両方に信頼感を抱くようになりうる。このような変化は、感謝の気持ちや現在の人生の状況についての有益な洞察を伴うことが多い。このような経験は、その後、トラウマ的な記憶や辛い感情が出てきたときに、共感的な意識の変化に伴う、より強い安全性の感覚を持ってアプローチするための基盤となりうる。この意識の拡大により、被検者は、トラウマやそれに伴う痛みを伴う感情を支配するという新たな感覚を身につけることができる
・被検者は、根底にある怒り、悲しみ、恥に対する初期の保護反応に基づく、長年の感情や行動パターンについての洞察を得ることが多い。自己受容が深まり、自己批判が減ることで、被検者は明晰さと自信、自己効力感を得て、展開する記憶、思考、感情に対して恐怖心が減り、よりオープンで好奇心旺盛な関係を築けるようになる。トラウマに関連した内容に直面したときに、極度の興奮ではなく、内なる静けさを感じることで、被検者は記憶や思考をより綿密かつ客観的に調べることができ、同時に強い感情を表に出すことができるようになると考えられる
・被検者者には、MDMAの急性作用は消失しても、MDMAを用いたセッションの効果は、セッション後の数時間から数日の間、継続することを伝える。被検者は、自分の経験について書いたり、提供された材料を使って作品を作ったりして、自分の展開する経験を探求し表現し続けることが推奨される。また、セッション後の数日間、覚えている夢に注意を払い、それを書き留めるように勧められる。
・実験的セッションの翌朝、その後1週間ずつ間をあけて、合計3回、各実験的セッションの後に90分間の統合的セッションが行われた。
・統合的セッションの目的は、 継続的な感情処理を促進し、日常生活のあらゆる困難に対処することであり、同時に、被検者が実験的セッションで得られた利益を日常生活に応用できるようにすること。セラピストは、被検者が治療体験のあらゆる側面を、自己、他者、そしてトラウマ史との新たな関係に織り込んでいくことを支援する
結果
・18週間でのCAPS-5総得点のMDMA群とプラセボ群の差は11.9点と有意差あり(MMRMによる解析)。プラセボに対するMDMAの効果量d=0.91
・解離のサブタイプにおいてもMDMA群のCAPS-5変化量は18週間で-30.8点、プラセボ群では-12.8点であり、MDMAの効果は明らかであった
・18週間での寛解率(CAPS-5で11点以下)はMDMA群 33%、プラセボ群 5%
プラセボ群の2名に重大な副作用(自殺関連行動や希死念慮による入院)がみられた。MDMA群では自殺関連行動については報告なし・MDMA群では筋肉のこわばり(63%)、食欲減退(52.2%)、嘔気(30.4%)、発汗過多(19.6%)、悪寒(19.6%)、落ち着きのなさ(15.2%)、浮動性めまい(13%)、眼振(13%)、はぎしり(13%)、散瞳(15.2%)、血圧上昇(10.9%)、胸痛(10.9%)、口渇(10.9%)などがみられた
・MDMAの薬理学的特性と治療を組み合わせることで、被検者が過覚醒や解離症状に圧倒されたり悩まされたりすることなく、トラウマ的な内容を再訪して処理することができる「耐性の窓」が生まれるのではないかと推測される
・COVID-19の影響で当初予定されているより参加者が少なくなった
・長期的有効性や安全性は不明
文献1:Nat Med. 2021 May 10. doi: 10.1038/s41591-021-01336-3.
文献2:Danilo De Gregorio et al. J Neurosci. 2021 Feb 3;41(5):891-900. -
逆説的反応について
2021年05月10日
・本来予想されるはずの作用の逆の反応が生じる逆説的反応(paradoxical reaction)ですが、精神科の臨床場面でも注意すべき以下の3つについて簡単にまとめておきます
(1)オピオイド誘発性痛覚過敏
(2)薬物乱用頭痛
(3)ベンゾジアゼピン奇異反応(1)オピオイド誘発性痛覚過敏
・これについては被引用数の多い総説を探してみたのですが、ちょっと古い2011年の総説(Pain Physician 2011; 14:145-161)しか見当たらず、最近のいくつかの文献も組み合わせてまとめてみました。
背景
・非癌性疼痛に対するオピオイドの使用が増えており、そのために多くの問題が生じている。・オピオイドの長期的有効性についてはエビデンスがなく、乱用やオピオイド誘発性痛覚過敏などの副作用の問題がある
・慢性的なオピオイド使用は、逆説的に急性疼痛を誘発したり、疼痛への感作をもたらしたりする可能性があり、オピオイド誘発性痛覚過敏と呼ばれている
・鑑別となるのはオピオイド耐性、オピオイド離脱であり(Singapore Med J 2012; 53(5): 357-360)、その発現機序には共通点があることが推測される。オピオイド誘発性痛覚過敏と耐性については、慢性オピオイド使用に伴い、疼痛が増悪する点で共通しているが、オピオイド誘発性痛覚過敏においては、痛覚感受性が変化しており、オピオイド増量の際にさらに疼痛が増悪する点において、耐性と異なる(耐性では疼痛は緩和する)。
・離脱においては痛覚過敏とアロディニアが特徴であり、オピオイド誘発性痛覚過敏と離脱は共にオピオイド使用に対する痛覚感受性の不均衡によるものである。ただし離脱はオピオイドの急激な減量により引き起こされるのに対して、オピオイド誘発性痛覚過敏では、オピオイドの用量は維持されているか増量された結果として起こりうる
・オピオイド誘発性痛覚過敏の疫学的情報は乏しい。
・症例対照研究において、メサドンを一定用量で慢性投与されている患者において、、オピオイド依存の既往のある患者や健常対照と比較して、寒冷昇圧試験における痛覚閾値の低下が報告されている(J Pain. 2003 Nov;4(9):511-9. )。
・一方で、電気的にあるいは機械的に誘発された疼痛については、オピオイド追加投与時の疼痛閾値において、オピオイド慢性投与のない対照群との差異を検出できなかったとの報告(Pharmacopsychiatry. 1996 Sep;29(5):176-9)があり、痛覚過敏は痛覚の種類による可能性がある。しかし明確な結論はでていない
・6例の慢性疼痛患者における前向き観察研究において、中等量のモルヒネ投与を開始後4週間以内に、寒冷昇圧試験における痛覚過敏が出現したことが報告されている(J Pain 2006; 7:43-8.)
・ほとんどのオピオイド誘発性痛覚過敏の報告がモルヒネなどの強オピオイド使用によるものであるが、比較的力価の弱い、トラマドールにおいても、痛覚過敏の2例報告がある(Pain Physician 2013; 16:41-44)。1例は1年間の慢性疼痛歴がある患者で、トラマドール400mg投与中で、疼痛が緩和しないためフェンタニルパッチなども追加投与されたが、鎮痛薬投与2時間後に疼痛がピークとなるためオピオイド誘発性痛覚過敏を疑われた症例である。もう1例は4年間トラマドール300mgなどを投与されていた慢性疼痛の患者で、トラマドール投与後に疼痛が増悪することと、トラマドールを増量するも疼痛が改善しないことなどからオピオイド誘発性痛覚過敏と診断されたケースである。いずれの症例もトラマドールを中止し、ミダゾラム2mg静注投与と、ケタミン2週間投与により疼痛が改善している。
発現機序
・痛覚受容経路の補償的なアップレギュレーションなどによるものが考えられている
・複数の発現機序が提唱されているが、はっきりしたことはよくわかっていない
(1)中枢グルタミン酸神経系
・最も多く関与の可能性が報告されている発現機序であり、NMDA受容体の関与が考えられている。
・オピオイド誘発性痛覚過敏の発症には、NMDA受容体の活性化が関与しており、NMDA受容体遮断により耐性とオピオイド誘発性痛覚過敏の発症を防ぐことができる。
・カルシウムで制御される細胞内プロテインキナーゼCが、耐性とオピオイド誘発性痛覚過敏の細胞メカニズムに関係している可能性が高い
・モルヒネの長期投与は、脊髄後角においてNMDA受容体を介したアポトーシスにより神経毒性をもたらす
・モルヒネの繰り返し投与により、後根神経節内の侵害受容性ペプチドであるカルシトニン遺伝子関連ペプチドやサブスタンスP濃度上昇が報告されている
・吻側延髄腹内側部(RVM)から生じる下行性疼痛促進経路の活性化によって生じるという仮説もある
(2)脊髄ダイノルフィン
・脊髄ダイノルフィン濃度はオピオイドμ受容体アゴニストの持続注入により上昇することが示されており、これにより一次求心性神経からのCGRPなどの脊髄興奮性神経ペプチドの放出につながると考えられている。末梢の侵害受容器刺激による興奮性神経ペプチドの増加が、侵害受容経路の亢進につながると考えられる
・吻側延髄腹内側部において、興奮性ペプチドの神経伝達物質であるコレシストキニン(CCK)の活性が高まると、脊髄ダイノルフィンを発現亢進する経路が活性化され、その結果、脊髄レベルでの侵害受容性入力が増強される
(3)下行性経路の促通
・オピオイド誘発性痛覚過敏に共通する機序として、吻側延髄腹内側部からの下行性促通経路の活性化があげられる
・吻側延髄腹内側部の神経細胞はオピオイドに対して特異的な反応を示し、下行経路を傷害すると、神経興奮性ペプチドの増加が抑制される
(4)遺伝的影響
・COMT遺伝子多型などが中枢性の疼痛調節機構や、オピオイド誘発性痛覚過敏発症に影響する可能性が報告されている
(5)侵害受容感受性の亢進
・オピオイド誘発性痛覚過敏の病態機序として、一次求心性線維からの神経伝達物質の再取り込み減少は、サブスタンスPやグルタミン酸などの侵害受容性神経伝達物質に対する脊髄神経の反応性亢進と共に、共通のメカニズムと考えられている。
・β2アドレナリン受容体の発現亢進が、オピオイド慢性投与中の変化として観察されている。またモルヒネ慢性投与による、中枢神経系におけるβ2アドレナリン受容体経路を介したシグナル伝達経路の機能的亢進も報告されている。
・いくつかの脳内ネットワークが疼痛の強力な調節因子として働き、特に前頭前野が痛覚知覚の抑制に関与していることが示されている。
・これらの機序に共通する経路として、中枢のカテコールアミン系によって部分的に調節される下行性疼痛抑制系の関与が考えられている。
・これらの経路の機能は、カテコールアミン分解酵素(COMT)活性によって遺伝的に影響を受ける。さらに、内因性オピオイド濃度の低下によるμオピオイド系の活性化能力の低下は、内因性疼痛抑制が効果的に機能せず、より顕著な疼痛感受性の亢進につながる可能性がある。しかし、実験的には、内因性オピオイド系はオピオイド誘発性痛覚過敏に有意な影響を与えないとの報告もある。
(6)その他の機序
・慢性疼痛におけるオピオイド使用が、肥満細胞の持続的活性化による侵害受容器の感作を引き起こし、さらにミクログリアの活性化と脊髄感覚神経の感作につながるとの考えがある。これら炎症促進性経路と痛覚感受性の亢進がオピオイド誘発性痛覚過敏の病態に関与しているとの仮説がある
・肥満細胞の脱顆粒は侵害受容器を活性化する物質を放出し、神経障害性疼痛の原因となる。活性化した肥満細胞は、好中球やマクロファージ動員を促進する。同時に上行性疼痛伝達経路を活性化し、おそらくは痛覚受容体へのヒスタミンの感作作用を介し触覚性痛覚過敏を誘発する。
・さらに神経栄養因子の放出により、TrKA受容体を介した侵害受容器の感作にもつながる
・肥満細胞は同時に、慢性内臓痛の重要な媒介因子である
・モルヒネやコデイン、その他のオピオイドは用量依存性に肥満細胞の炎症促進性サイトカインやサブスタンスPなどを含む脱顆粒を引き起こす。
・ミクログリアもオピオイドに感受性が高く、慢性疼痛における慢性的なオピオイド投与により活性化型となり、CD11bなどを発現する。ミクログリアはμおよびκオピオイド受容体を発現しており、TNFやIL-6,10などのサイトカイン、BDNFなどの放出やプリン受容体やTLR4(Toll-like receptor 4)の発現亢進につながる。いずれも神経炎症に関与しうる
・プリン受容体(P2X4R)活性化に引き続くBDNF放出は、その受容体である脊髄痛覚感受性神経上のTrkB受容体と相互作用し、KCC2(co-transporter 2 of potassium chloride)の発現低下とそれに引き続く塩素イオン恒常性異常につながる。このような病態がオピオイド誘発性痛覚過敏の病態に関与していると考えられている
治療薬候補
・グルタミン酸神経系とNMDA受容体の病的活性化が病態に関与していると考えられており、NMDA受容体拮抗作用を有する薬剤が治療薬候補として提案されている
(1)ケタミン
・ケタミンはNMDA受容体のフェンサイクリジン結合サイトに結合し、拮抗的に作用する
周術期の疼痛管理においてオピオイド投薬時に低用量ケタミンを併用する介入試験のメタ解析では、結果は一定していない。システマティックレビューにおいても、癌性疼痛におけるオピオイド治療の有効性を改善するとのエビデンスを示すことができていない。・ただし、高用量オピオイドの投薬を必要とするケースや、ある程度のオピオイド耐性が存在するケースにおいては、ケタミンの有用性が示唆する報告もある。今後さらに大規模介入試験での検証を要する
(2)メサドン
・メサドンは弱いNMDA受容体拮抗作用を有する
・メサドンは、高用量オピオイドにより生じたオピオイド誘発性痛覚過敏の症状改善に有効であることが示唆する報告がある。メサドンへのオピオイド・ローテーションが痛覚過敏の改善に有効であったとの複数の報告がある
・ただし、メサドンは高用量においてTorsades de Pointsなど有害性のリスクがあり、またメサドン自体がオピオイド誘発性痛覚過敏を増悪させたとの報告があり、注意を要する
(3)デキストロメトルファン(商品名:メジコン)
・デキストロメトルファンは非競合型のNMDA受容体拮抗作用を有しており、鎮咳薬として使用されている
・しかしながら、MorphiDex(モルヒネ:デキストロメトルファン=1:1の合剤)とモルヒネを比較する、非癌性慢性疼痛に対する3つの大規模介入試験の結果は、有効性に関してMorphiDexとモルヒネの有意差は全く見いだされず、デキストロメトルファンを併用することの有用性は支持されなかった
(4)COX-2阻害剤
・プロスタグランジンは、侵害受容経路を調節することが示されており、脊髄後角において興奮性アミノ酸であるグルタミン酸の放出を刺激することことから、COX阻害剤は、中枢神経におけるNMDA受容体の機能に拮抗することが示されている
・また、COX阻害剤は、動物実験ではオピオイド耐性の発現を抑制することも示されている。したがって、cox-2阻害剤はオピオイド誘発性痛覚過敏の発症を抑制することができるのではないかと考えられていた
・COX-2阻害剤の予防的投与がヒトのオピオイド離脱時の疼痛や、オピオイド誘発性痛覚過敏を緩和するとの報告(Anesthesiology. 2006 Nov;105(5):1016-23.)がある。しかし発症後投与では有効ではなかったとされており、NMDA受容体作動薬ほどオピオイド誘発性痛覚過敏の病態への影響は大きくないと考えられている
(5)α2受容体アゴニスト
・α2受容体アゴニストのクロニジンがオピオイド誘発性痛覚過敏の症状改善に有効であったとの報告がある。しかしラットでの実験では、クロニジン単回投与後に一過性の鎮痛作用がみられたものの、その後遅発性に温度覚への過感受性がみられたとの報告があり、その有効性については動物実験では相反する報告があり、一定していない。
現実的なオピオイド誘発性痛覚過敏への対処
・非癌性疼痛に対するオピオイド使用の際には必要最低限、可能な限り短期間とする。非薬物療法や鎮痛補助薬(デュロキセチン、プレガバリン、ガバペンチンなど)などの使用を
・オピオイド減量の際には急な減量を避ける
・異なるオピオイドを組み合わせるオピオイド・コンビネーションないしオピオイド・ローテーション
・COX-2阻害薬との併用療法
(2)薬物乱用頭痛
・薬物乱用頭痛については、2019年のLancet Neurology誌に総説(Lancet Neurol. 2019 Sep;18(9):891-902)がでていましたので、これを中心にまとめます。
背景
・薬物乱用頭痛(medication overuse headache)は二次的な慢性頭痛であり、鎮痛薬や片頭痛治療薬の頻回使用により生じる・ICHD-3(International Headache Society)の診断基準では、原発性頭痛に対して1ヶ月間に10日(エルゴタミンとトリプタン)ないし15日以上(鎮痛薬)の薬剤過量使用が3ヶ月以上持続し、その結果、1ヶ月のうち15日以上頭痛を生じるものとされている。
・頭痛以外の慢性疼痛、例えば慢性腰背部痛に対する鎮痛薬の頻回使用は、もともと片頭痛を有する患者の頭痛の頻度を増悪させることが知られている
・診断はrecall biasの影響を受けるため容易ではない。罹患率は報告によりばらついており中間値は1-2%程度。男女比4:1.50-60歳台が最多。
・薬物乱用頭痛のリスク要因としては、社会経済的に低い立場、ストレス、肥満、低活動、喫煙など
・予防することが重要
予防について
・鎮痛薬や片頭痛治療薬の使用を最高で週に2日までに控えるように教育すること
・服薬状況と頭痛について自己記録をすること
・イタリアでの100名の薬物乱用頭痛患者に対する15分間の教育セッション実施により、ベースラインでは平均、1ヶ月間24日間の頭痛と22日間の服薬をしていたが、教育により2ヵ月後に79%の患者が服薬頻度を減少させ、69%が50%以上の頭痛頻度の減少をみた
離脱および予防的治療
・175名の薬物乱用頭痛(片頭痛ないし緊張型頭痛)を対象にした研究で、鎮痛薬など離脱2ヶ月後において、45%が頭痛頻度の50%以上の減少を示したが、48%は不変で、7%が増悪した。改善しなかった88名についてうち80名が薬物療法(片頭痛治療薬などの再開)ないし非薬物療法(誘発因子を避ける、運動、認知行動療法など)に反応し平均26%の頭痛頻度の減少を示した
・デンマークでの小規模試験では、薬物乱用頭痛患者72名を2ヶ月間投薬頻度を週2日までに制限する群と、完全に断薬する群とに無作為割付し、6ヵ月後の状態を評価したところ、断薬群では頭痛頻度が46%減少し、制限群では22%減少し、1ヶ月あたりの片頭痛日数も断薬群では平均7.2日減少し、制限群では3.6日の減少であった。この結果から、二ヶ月間の完全な断薬が、より頭痛頻度の減少に有効であることが示唆された
・COMOESTAS試験は、多施設オープン試験であり、492名の薬物乱用頭痛患者(トリプタン、エルゴタミン、配合鎮痛薬などが原因薬剤)がエントリー(89%が片頭痛)。薬物中断と同時に頭痛予防薬の使用は許可(1-7日目まではアセトアミノフェン1gを1日3回までないしナプロキセン(NSAIDs) 500mgを1日2回まで。8日目以降はこれまでに使用経験のない鎮痛薬は対症治療薬として許可)。最初1ヶ月で頭痛頻度は44%減少し、6ヵ月後には60%減少した。
・片頭痛患者に対するトピラマートの有効性を検証した2つの介入試験があり、アメリカでは306名がエントリー、ヨーロッパでは59名がエントリーし、アメリカではnegative、ヨーロッパではpositiveな結果であった。結果の差異が生じた理由として、アメリカでは薬物乱用頭痛患者が38%、ヨーロッパでは78%であり、アメリカでは乱用薬物はNSAIDsが多く、ヨーロッパではトリプタンであった。従って片頭痛患者の薬物乱用頭痛に対してトピラマートは代替薬として選択肢になりうるかもしれない
・慢性片頭痛患者に対してボトックス(onabotulinumtoxin A)の予防効果(7つの頭頸部筋群の31箇所に計155単位筋注。12週間あけて2回)を検証した介入試験がある。1384名中904名が薬物乱用頭痛患者であり、この患者群について結果を分析したところ(大半がトリプタン)、ボトックスは有意に良好な結果となった(頭痛日数の減少が-8.2日/月(ボトックス)対-6.2日/月(プラセボ))
・慢性片頭痛患者で薬物乱用頭痛を併発した患者に対してfremanezumab(カルシトニン遺伝子関連ペプチド:CGRPをターゲットとするモノクローナル抗体:675mg単回皮下注ないし225mgずつ4週に1回合計3回皮下注)が投与され、プラセボと比較され、12週後に1ヶ月あたりの頭痛日数の変化は単回投与群で-4.7日、3回投与群で-5.2日、プラセボ群で-2.5日で有意差あり。Fremanezumabは片頭痛における薬物乱用頭痛に対して有効。CGRP受容体が片頭痛発症に関連していることが示唆されている
・トピラマート、ボトックス、fremanezumabは、乱用薬物の中断することなく頭痛頻度を減少させており、薬剤からの離脱が困難な患者についても選択肢になりうる
・薬物乱用頭痛患者において、薬剤中断後の頭痛頻度減少に、アミトリプチリンの有効性が小規模の介入試験で示されている(17名の小規模試験。9週後に頭痛頻度はアミトリプチリンで45%減少、プラセボでは28%減少)
離脱症状への治療
・慢性頭痛かつ薬物乱用頭痛を有する患者において、乱用薬物を中断する際に、反跳性頭痛の症状を緩和するために、プレドニゾロン60mg(2日間60mg、その後20mg/dayずつ減量)の有効性を検討したオープン試験では有効性を示唆する結果がえられた(プラセボ対照ではない)が、97名を対象としたプラセボ対照試験では、頭痛頻度などにおいて有効性は確認できなかった。今後さらに検証が必要
・97名の患者を対象に、10日間のセレコキシブないしプレドニゾン投与とを比較した介入試験では、3週後にセレコキシブ群では有意に頭痛強度が減少したが、頻度は有意差なし
まとめ
・慢性頭痛患者については、まずは薬物乱用頭痛を引き起こさないように教育を行う
・薬物乱用頭痛患者に対しては、乱用薬物を中断するか、週に2日までの使用に控えるように指導する。薬剤を使用する場合に、これまで使用した薬剤とは別の薬剤を推奨すべきかどうかは定かでない。薬物からの離脱が困難ないし、離脱しても頭痛が残存ないし増悪の場合には、トピラマート、ボトックス、抗CGRPモノクローナル抗体などが選択肢となりうるかもしれない
(3)ベンゾジアゼピン奇異反応
・ベンゾジアゼピン奇異反応については、本来抗不安作用や鎮静作用を発揮すべきベンゾジアゼピン系薬剤により、却って不安や焦燥感が増悪し、情動易変性や敵意、攻撃性、興奮などを呈する病態とされています。抑うつや躁症状、精神病症状なども奇異反応に含まれるようです。ただ、このような報告は2000年くらいまでの海外の古い文献に多く、今では考えられませんが、海外では超大量のベンゾジアゼピン(ジアゼパム換算で1日40mgとか)が使用されたりした介入試験(例えばJ Clin Psychiatry. 1996 Aug;57(8):349-55)なども存在していたため、ここまで大量に使用すれば、それは耐性でも離脱でも依存でも脱抑制でもせん妄でも、何でもありなような気がしますし、区別すべき病態といえます。
・実際にパニック症に対する8週間の介入試験の論文(J Clin Psychiatry. 1996 Aug;57(8):349-55)では、ジアゼパム平均43mg(n=81)とアルプラゾラム平均4.9mg(n=78)がプラセボ(n=79)と比較されましたが、副作用の表を見てみると、図のようにジアゼパム群、アルプラゾラム群ともに、性欲の減退、食欲の減退と同じか、それ以上の比率で、性欲の亢進(ジアゼパム群では18.5%。プラセボでは3.9%)、食欲の亢進(ジアゼパム群32.1%,プラセボでは14.3%)がみられており、プラセボ群とも有意差があることから、これは奇異反応というよりも高用量ベンゾジアゼピンによる脱抑制と言ってもいいのかもしれません。また思考障害(これが具体的にどのような内容なのかわからなかったですが)の副作用も有意に多くなっており、奇異反応とされうる症状に通じる副作用といえるかもしれません。
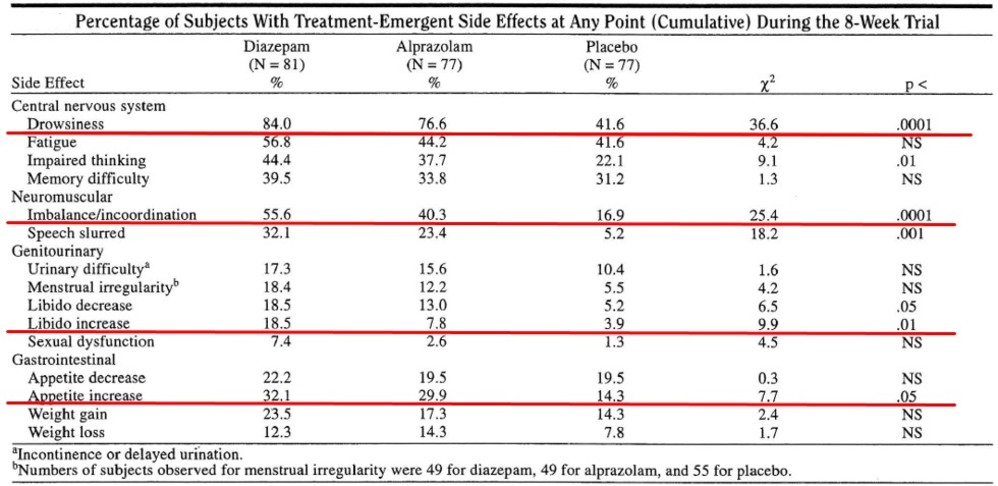
・このように一般には高用量ベンゾジアゼピンでみられうる脱抑制的反応ですが、実際には常用量においても観察されうることには注意が必要です。以前のベンゾジアゼピンに関するブログ記事でも取り上げましたが、ベンゾジアゼピンの長期使用は耐性によりもはや何の効果もなく、むしろ慢性のベンゾジアゼピン投与を受けているケースについては、ベンゾジアゼピンを中断した方が、不安得点や疾患の重症度が改善したとの報告(Br J Psychiatry. 1990 Mar;156:406-11. )もあることなどに注意を要します(離脱の際に一過性に不安などが増悪しうるが、その後改善を示す)。
・一方で、倉田ら(臨床精神薬理 11(2) 253-259, 2008)の報告にあるように、アルコール依存症患者や小児、高齢者、脳器質疾患の合併例など中枢神経系の脆弱性が想定されるケースにおいては、奇異反応出現のハイリスクとされており、ベンゾジアゼピン投与による精神症状の増悪リスクに注意を要します。
・慢性にベンゾジアゼピン投与が継続されている場合、なかなか中止にもっていくことが困難になっているケースも多くあります。
・緊張病やレム睡眠行動障害、むずむず脚症候群、さらには最近の東京医科歯科大学からの興味深い報告(Shiwaku H. et al. J Clin Med. 2020 Jun 21;9(6):1938)として、精神病性うつ病における再発予防の可能性など、ベンゾが活躍しうる臨床場面は確かにありうるのですが、ベンゾジアゼピン系薬剤の使用はできるだけ短期間、必要最低限の用量でということが望ましいといえます
-
パニック症の治療薬候補となるか
2021年04月26日
・専攻医勉強会でパニック症に入ったのですが、ここ5年間程目立った介入試験もなく、前回使用した資料にRANZCP 2018ガイドラインを付け加えるだけという少し寂しい状況でした。ただ基礎実験レベルでは新たな動きもあるようです。先日オレキシン2受容体選択的拮抗薬のセルトレキサントが大うつ病において第3相試験までいっていることを当ブログでも紹介しましたが、今回はオレキシン1受容体選択的拮抗薬について、パニック症の動物実験や第1相試験が行われているという話題(J Exp Pharmacol. 2021 Apr 15;13:441-459)です。まだ第1相なので、この話題はいずれ消えてなくなる話かもしれません。そもそも基礎実験段階での新薬候補が上市される確率は何万分の1というものなので、動物実験で良い成績が得られてもそれがそのままヒトに通用するかというと、そう簡単にはいかない状況は多くあります。
・動物実験とヒトとのギャップを埋めるために患者iPS細胞由来の細胞モデルによる薬剤探索も活発に行われていますが、これが精神疾患となると、簡単にはいかないことと思われます。
・以下論文のオレキシン1受容体拮抗薬に関する部分の概略となります
********
・オレキシン1受容体拮抗薬である化合物56(compound 56)は、その他のオレキシン1受容体拮抗薬(SB-408124 、GSK-1059865 など)と比較して血液脳関門透過性や受容体選択の特異性などにおいて優れており、基礎実験で使用されている。
・乳酸ナトリウムを投与したパニック脆弱性を有するモデルラットにおいて、化合物56は行動異常と心血管系応答の異常を有意に改善した。鎮静作用は確認されなかった
・オレキシン1受容体拮抗薬(化合物56)とオレキシン2受容体拮抗薬(JnJ10397049)、デュアルオレキシン受容体拮抗薬(スボレキサント類似化合物)の作用特性を比較するため、20%二酸化炭素吸入パニック誘発モデルラットが使用された(Johnson PL et al. Depress Anxiety. 2015 Sep;32(9):671-83.)。ロラゼパム対照で行動異常と心血管系応答の異常への効果が比較された結果、オレキシン1受容体選択的拮抗薬はモデルラットの行動異常と心血管系異常を改善し、デュアルオレキシン受容体拮抗薬は行動異常のみを改善、選択的オレキシン2受容体拮抗薬はいずれの改善効果も示さなかった。
・さらに別の選択的オレキシン1受容体拮抗薬であるJNJ-54717793についても、動物実験でパニック症モデル動物に対する効果が調べられている。JNJ-54717793は、乳酸ナトリウム投与および20%二酸化炭素吸入モデル動物において、鎮静作用をもたらすことなく、心血管系応答異常と行動異常を改善することが示されている
・選択的オレキシン1受容体拮抗薬であるJNJ-61393215は20%二酸化炭素吸入モデル動物において、社会的相互作用テストにおける不安様行動を改善し、高用量においては心血管系応答の異常も改善することが報告されている。この物質も明らかな鎮静作用はなく、睡眠覚醒リズムへの影響もほとんどなかった
・JNJ-61393215は健常成人における第1相試験も実施されている(Transl Psychiatry. 2020 Sep 7;10(1):308)
・35%二酸化炭素 / 65%二酸化炭素の短時間(1分)吸入によるパニック誘発試験でPSL-IV得点で合計4点以上かつ少なくとも4つの症状尺度で1点以上の増加を示し、恐怖関連症状のVASで25mm以上の増加を示した39名が対象となった
・対象者らは二重盲検クロスオーバー試験により、JNJ-61393215を25mgないし90mg、アルプラゾラム2mg、プラセボの4群で比較された。6日間投与後に35%二酸化炭素2回吸入試験が行われた。その結果、JNJ-61393215を90mg投与された群とアルプラゾラム2mg投与群はプラセボと比較して有意にPSL-IV総得点の改善効果がみられた。血圧や心拍数については有意な効果はみられなかった。
・別のオレキシン1受容体拮抗薬であるACT-539313でも第1相試験が行われており、無作為割付クロスオーバー試験でACT-539313とプラセボの効果が比較されている(Prog Neuropsychopharmacol Biol Psychiatry. 2021 Jun 8;108:110166)。健常者30名が対象となり、参加者らは、ACT-539313を200mg投与とプラセボで比較され、2.5日間投与後に二酸化炭素吸入試験を受け(20分間7.5%二酸化炭素吸入、その後10分休憩し、35%二酸化炭素を単回吸入を行った)、VASやGAD-C、PSI得点、および心血管系パラメータや血清コルチゾールおよび血漿ACTH濃度が測定された。結果は全体としてはACT-539313とプラセボの有意差はなかったが、警戒感と不安のVAS得点については、プラセボよりも良好な結果であった。血圧や心拍数などはプラセボと有意差がなかった。一方で血清コルチゾール濃度はACT-539313投与後がプラセボ投与後よりも低値であった。 ACT-539313の抗不安作用については限定的な結果となっている
********
・以上となりますが、Johnsonらの結果によれば、オレキシン2受容体拮抗薬はうつ症状には良いかもしれないけど、不安には期待できないということでしょうか。まだこれまでの結果を実臨床に外挿するのは時期尚早かもしれません。
・JNJ-61393215は不安を伴う大うつ病に対する第2相試験が行われているようです(NCT04080752)。ACT-539313についてはどんな根拠でか過食性障害に対する第2相試験が行われているようで、これもどんなことになるのか興味深いところです(NCT04753164)
・パニック症に対するいくつかのガイドラインをみていて、専攻医の先生方にも伝えたのですが、軽症から中等症までのところでは精神療法(特にCBT)が第1選択となりうるため、学会のワークショップなどでCBTのセッションがあったら積極的に参加しましょうということを伝えました。ただこのコロナ禍においては、対面式のセッションが実施できないため、実技的な研修が滞るという問題があります(ウェブだと患者さんを対象とした実演映像などもセキュリティの問題から流せないことが多い)。その意味でも一刻も早い終息が望まれるところです
-
psilocybin
2021年04月19日
・psilocybin(シロシビン、nativeの発音ではシロサイビンが近い)はマジックマッシュルームの成分であり、催幻覚作用のある違法薬物です。今回6週間に2回投与でエスシタロプラムとの比較で慢性期大うつ病への有効性や安全性が検証されたのでみてみます(文献1)。psilocybinはセロトニン2A受容体アゴニスト作用を有しており、LSDと類似の作用機序を有することとなります。LSDによるセロトニン2A受容体アゴニスト作用が自我障害(社会的場面において自己意識を保持する機能や共同注意機能を障害する可能性があり、自己と他者との境界の不明瞭化といった病的体験に通じる症状と関連する可能性がある)と関連するとの報告(J Neurosci. 2018 Apr 4;38(14):3603-3611.)もあり、このあたりの副作用についてはどうなのか気になるところです。
・催幻覚作用のある薬剤といえば、2019年にFDAより治療抵抗性うつ病に承認されたエスケタミン点鼻薬も思い浮かびます。こちらはNMDA受容体遮断作用を有する薬剤となり、投与開始第1週から第4週目までは1週間に2回投与、5週目から8週目までは週に1回投与、その後は1-2週間に1回投与となります。ただし、点鼻後に血圧上昇リスク、鎮静リスク、解離症状や知覚変容、離人感などのサイケデリック体験のリスク(61-75%に出現とされる)があるため投与後2時間の血圧モニターなど経過観察が必要なこととなど、かなり厳格な管理が必要とされる薬剤になります。治療抵抗性うつ病に対する介入試験で、投与1時間後からMADRSでプラセボと有意差が生じたことには驚きました(JAMA Psychiatry. 2018 Feb 1;75(2):139-148. )
・今回はpsilocybinの大うつ病に対する第2相試験として行われましたが(NCT03429075)、サイケデリック体験のリスクに対して、心理的介入を併用するなどかなり手間のかかる介入が行われています。
背景
・催幻覚物質であるpsilocybinは、その代謝物であるシロシンのリン酸エステルである。psilocybinとシロシンは、催幻覚作用を持つシロシベ属のキノコに存在する
・シロシンの主な作用は、5-HT2A受容体アゴニスト作用により生じる
・psilocybinは、20世紀半ばには気分障害や依存症の心理療法の補助療法として使用されていた。これまでに、うつ病および不安症に対するpsilocybinのオープン試験が1件、無作為化割付試験が4件実施されている。
・治療抵抗性うつ病患者を対象とした小規模オープン試験を含め、いくつかの患者集団を対象とした試験で、psilocybinを1~2回投与した後に抑うつ症状の軽減が報告されている。
・今回エスシタロプラムを対照として、psilocybinの中等度から重度うつ病に対する6週間の無作為割付試験を実施した
対象と方法
・18-80歳の大うつ病患者でエスシタロプラム投与歴のないもの。精神病の既往のないもの。重大な自殺企図歴のないものなど
・ビデオ面接でHAM-D17が評価され、17点以上がエントリー。GPからの情報によりうつ病の診断を確認
・試験開始2週前までにすべての向精神薬を中止。精神療法も3週前までに中止
・無作為割付二重盲検比較試験
・psilocybin n=30 (1日目朝に25mg摂取。3週後に2回目のpsilocybin25mg投与)
・プラセボ n=29 (1日目にpsilocybin1mg投与、その後1週目から3週目までエスシタロプラム10mg、3週目から6週目まで20mg、朝食後投与)
・幻覚体験が起こりうるため、そのリスクを最小限に抑えるため、心理的サポートが提供された。
・事前に治療的意図の説明や感情制御の方法などの3時間のセッションが提供された。幻覚体験により痛みを伴い内容を経験した際にはそれらを完全に受け入れて探求することが奨励された。また、アクセプト・コネクト・エンボディ(ACE)モデルに基づいて、挑戦的な感情を受け入れ、個人的な意味や価値観につながり、自分の身体に同調するスキルを強化するための視覚化訓練を行った。
・psilocybin投与日には録音済みの音楽を鑑賞、投与開始翌日、1週後、3週後(psilocybin投与2回目の翌日)に催幻覚作用を有する薬剤内服後の心理的デブリーフィングを実施。デブリーフィングでは、ガイドと呼ばれる専門家が参加者が体験した内容を説明するのを傾聴した。その後、参加者は経験した感情にアクセスしやすくするために、視覚化演習を行うことを選択可能とされた。
・試験期間:6週間
・主要評価項目は6週間でのQIDS-SR-16の変化量。副次評価項目はQIDS-SR-16で定義された反応率(50%以上の改善)と寛解率(5点以下)、HAM-D17、BDI-1A、MADRS、STAI、BEAQ(Brief Experimental Avoidance Questionnaire)、WSAS(Work and Social Adjustment Scale)、SHAPS(Snaiith Hamilton Anhedonia Plesure Scale)など
結果
・psilocybin群の平均罹病期間は22年、エスシタロプラム群の平均罹病期間は15年。
・エスシタロプラム群は29名中4名が副作用で中断。1名がコロナウイルス関連問題(ロックダウン)で中断
・psilocybin群は30名中2名がコロナウイルス関連問題(ロックダウン)で中断。1名がプラセボカプセル内服を中止(プラセボと推測したため)
・6週間のQIDS-SR-16の変化量はpsilocybin群 -8.0±1.0、エスシタロプラム群 -6.0±1.0(有意差なし)
・副次評価項目であるQIDS-SR-16での反応率はpsilocybin群70%、エスシタロプラム群 48%で有意差なし。寛解率はpsilocybin群 57%、エスシタロプラム群 28%で有意差あり
・副作用出現率はpsilocybin群 87% 、エスシタロプラム群 83%。不安の増悪と口喝についてはエスシタロプラム群で多かった。psilocybin群では頭痛が最多でだいたい投与24時間以内に生じていた
結論
・psilocybinは短期的にはわずか2回の投与でエスシタロプラムに有意差ない有効性を示した
・psilocybinによるサイケデリック体験は有害事象に含まれなかった(feeling abnormalの項目はあり、これについてはpsilocybin群は0例、エスシタロプラム群では3例)。それは先行研究でサイケデリック体験は良好な転帰と関連する可能性を示唆する結果が報告されているからである。
・今後さらに大規模で長期の試験により、psilocybinの有効性と安全性を確認することが必要
コメント
・3週間に1回の投与でこの結果は驚きですが、心理的サポートも手厚かったので、プラセボと比較したらどうかも気になります。今後、ケタミンとの比較試験(NCT03380442)、治療抵抗性うつ病に対するニコチンアミド対照試験(NCT04670081)などが予定されており、どのような結果が報告されるのか興味深いところです。多くの抗うつ薬がセロトニン2A遮断作用を有するため、その反対の薬理作用を有する薬剤が抗うつ作用を発揮するとなると、わけがわからなくなりそうですが、おそらくセロトニン系以外の作用も関与しているのでしょう。薬理作用についてはそう単純ではないということかと思います。
文献1:Robin Carhart-Harris et al. N Engl J Med. 2021 Apr 15;384(15):1402-1411. doi: 10.1056/NEJMoa2032994.
-
メチルフェニデートと催奇形性について
2021年04月12日
・若い方にADHD治療薬を処方する機会もあるため、催奇形性リスクについて調べておこうと思ったら、アトモキセチンとグアンファシンについてはそれぞれの薬剤のみで検討された疫学的研究がまだなく、よくわからない状況です。現実的には添付文書に従い、アトモキセチンについては”治療上の有益性が危険性を上回ると判断される場合にのみ投与すること”、グアンファシンについては”妊婦又は妊娠している可能性のある女性には投与しないこと”となります。
・メチルフェニデート徐放剤については、添付文書では”妊婦又は妊娠している可能性のある女性には投与しないことが望ましい”との記載になっています。メチルフェニデートについては海外では妊娠中の投与例もこのところ増えており、大規模な疫学的研究による報告が散見されるようになってきています。FDAでは既に廃止された分類ですが、カテゴリーC(危険性を否定することができない)に分類されており、海外の添付文書ではラットでの実験結果が記載されており”ラットを用いた研究では、30mg/kg/dayまでの経口投与で胎仔に害を及ぼす証拠はなく、これは、mg/kgおよびmg/m2ベースに換算するとそれぞれコンサータのヒトへの最大推奨投与量の約15倍および3倍にあたる。妊娠ラットにおけるメチルフェニデートとその主な代謝物であるPPAへの暴露量は、AUCに基づくと最大推奨量のコンサータを使用したボランティアおよび患者を対象とした試験で見られた値の2倍になる”とのことです。
・妊娠第1三半期のメチルフェニデート内服と催奇形リスクとの関係については、疫学的研究から得られている結論から言うとまだはっきりしたものはでていないということになりますが、その理由としては暴露による催奇形リスクの増加量がおそらくは小さい(高々1%程度)ことと、メチルフェニデート暴露妊娠例がまだ少ないということがあります(それでも年々かなりの割合で増えてきているようです。文献2ではデンマークにおいて妊娠中におけるADHD治療薬処方は2003年には10万人年当たり5人でしたが、2010年には10万人年あたり533名に増加しているとのことで、7年間で100倍になっており増加率に驚きました)。
・たとえば文献1のメタ解析で対象となった2つのコホートに含まれた人数は、大奇形に関してメチルフェニデート暴露群はn=3474(アメリカと北欧の2つのコホートの合計)、非暴露群はn=4373963となっています。
・この報告で共変量としてアメリカのMedicaidデータベースからのデータについては、年齢、出生年、人種、多胎妊娠、精神疾患合併症、アルコール依存ないし乱用、薬物依存ないし乱用、喫煙、慢性疾患(糖尿病、高血圧、肥満、腎臓病)、向精神薬処方(抗てんかん薬、抗うつ薬、抗不安薬、抗精神病薬、ベンゾジアゼピン系など)、その他の併用薬剤などが抽出されました。北欧(デンマーク、フィンランド、アイスランド、ノルウェー、スウェーデン)のレジストリからのデータについては共変量として、年齢、出生年、出生順、性別、出産方法、喫煙、BMI、精神疾患による入院歴、催奇形性薬剤の服用などが抽出されました。
・あらゆる大奇形の調整後の相対リスク(RR)については、アメリカからのデータでは調整後RR=1.11(95% CI 0.91-1.35)、北欧からのデータについては調整後RR=0.99(95% CI 0.74-1.32)となり、全体としてRR=1.07(95% CI 0.91-1.26)となり、非暴露群と暴露群とで有意差はでませんでした。また心血管系奇形の相対リスクについては、アメリカからのデータでは調整後RR=1.28(95% CI 0.94-1.74)、北欧からのデータでは調整後RR=1.28(95% CI 0.83-1.97)となり、この2つをひっくるめると全体として心血管系奇形の相対リスク=1.28(95% CI 1.00-1.64)となり、ぎりぎり有意差がでている感じです。それでも各データの調整を行った共変量の内容が異なっており(北欧のはアルコール乱用の有無とかが入っていないなど)、そのあたりを加味すると、結果の信頼性という点ではまだまだという気がします。
・絶対的なリスク値(未調整)についてはMedicaidからのデータによると、あらゆる大奇形の発生率は非暴露群で3.5%、暴露群では4.59%であり、心血管系奇形の発生率は非暴露群で1.27%、暴露群で1.88%となりました。抗うつ薬の時もそうでしたが、暴露群と非暴露群とで絶対リスクの差が1%を切るような疾患については、疫学的に暴露、非暴露での有意差を確実に抽出するのはとても大変な作業になっている印象です。
・ちなみに文献1において、心血管系奇形のさらにどのような奇形が有意にメチルフェニデートにより増加していたかについては、Medicaidからのデータの解析ではConotruncal and major arch anomalies(調整後RR=3.44 95% CI 1.54-7.65)となっており、心房中隔欠損および心室中隔欠損については有意差がみられませんでした。北欧からのデータについては、どの心血管系奇形についてもはっきりと暴露との関係性を示せたものはありませんでした。
・今回、新たな視点から、メチルフェニデートの催奇形性について検討した論文が出ました(文献2)。どのような点が新しいかと言うと、これまで報告された結果は、催奇形性については生児出産例のデータによるものであり、死産や流産に至る重度奇形に関するデータは含まれておらず、生児出産例のみのデータではsurvivor biasにより、真の奇形リスクが低く見積もられる可能性があるということから、妊娠中の超音波検査により判明した奇形、死産、流産、奇形などのデータも収集し、妊娠第1三半期におけるメチルフェニデート暴露と催奇形性との関連を検討したという点です。
・対象となったのはデンマークの5つの全国データベース(the Danish Fetal Medicine Database, the Danish National Patient Registry(妊娠22週以前の死産ないし流産の情報), the Danish Medical Birth Registry, the Danish Health Services Prescription Database)であり、2007年11月から2014年2月までの単胎妊娠の胎生11週からの情報が収集されました
・共変量として、人種、伴侶の有無、未経産ないし経産、妊娠年齢、BMI、妊娠中の喫煙、妊娠180日前から妊娠第1期までの既知の催奇形性薬剤の処方の有無、妊娠2年前のADHD診断ないし糖尿病診断の有無、妊娠2年前から第1期までの降圧薬や糖尿病治療薬、抗てんかん薬、抗精神病薬、抗不安薬などの処方歴などのデータが抽出されました。
・log-binomial回帰法により罹患率比(PR : prevalence ratio)が算出(オッズ比ではなく、暴露群が非暴露群の何倍リスクが高いかを算出)されました。
・364012例の単胎妊娠が対象となり、うち96%で超音波検査のデータがありました。妊娠第1期へのADHD治療薬への暴露率は0.16%(n=569)であり、うち83%がメチルフェニデートでした。ADHD治療薬暴露群は非暴露群と比較して、より若年で、喫煙率が高く、向精神薬投薬率が高い傾向がありました。
・あらゆる理由による11週以降の妊娠終了はADHD治療薬暴露群で9.8%、非暴露群では2.6%(暴露群の大半が胎児が原因による妊娠終了ではなかった)であり、全体の奇形率はメチルフェニデート暴露群では5.1%(29例)、非暴露群では4.6%でした。心奇形率はメチルフェニデート暴露群で2.1%、非暴露群では1.0% であり、重症心奇形についてはメチルフェニデート暴露群0.9%、非暴露群0.2%となりました
・メチルフェニデートについては、調整後PRは全奇形について1.04(95% CI 0.70-1.55)、心奇形は1.65(95% CI 0.89-3.05)、重症心奇形 2.59(95% CI 0.98-6.90)でした。心奇形のうちわけについては、12例中10例が中隔欠損であり、心房中隔欠損の調整後PRは1.21(95% CI 0.45-3.21)、心室中隔欠損の調整後PRは2.74(95% CI 1.03-7.28)となりました。一方中枢神経系奇形の調整後PRは2.03(95% CI 0.65-6.27)となりました。
・暴露症例数が少ないため、確定的なことは言えませんが、妊娠第1三半期におけるメチルフェニデート内服により、一部心奇形の発生リスクがわずかながら上昇する可能性があるという結果になりました。
文献1:JAMA Psychiatry. 2018;75(2):167-175.
文献2:J Clin Psychiatry. 2021 Jan 5;82(1):20m13458. doi: 10.4088/JCP.20m13458




