-
亜酸化窒素(笑気)
2021年07月06日
・エスケタミンが2019年3月5日にFDAより治療抵抗性うつ病に対する抗うつ薬併用療法として承認されました。もともと麻酔薬として承認されているケタミンですが、NMDA受容体拮抗作用により抗うつ作用を発揮すると考えられています。その効果は投与開始2時間後から明らかで、速効性があると言われています(JAMA Psychiatry. 2018 Feb 1;75(2):139-148. )。
・NMDA受容体拮抗薬が抗うつ作用を有するかもしれないということは、すでに1990年頃からマウスの実験で言われていたようです(Molecular Psychiatry vol. 23, 801–811 (2018))。さらに各種抗うつ薬のマウスへの慢性投与によりNMDA受容体への放射性リガンドの結合が減少することが報告され、抗うつ薬慢性投与によりNMDA受容体の適応的変化が生じることが推測されていました。
・ケタミンは、健常者の前頭前野において神経活動を増加させることが示されていて、これはGABA作動性介在神経に発現しているNMDA受容体を優先的に阻害するためと考えられているようです。GABA介在神経の抑制による皮質活動の脱抑制が迅速な抗うつ作用発揮の要因との仮説も存在しますが、一方で、GABA介在神経の活動を賦活化するとマウスで抗うつ作用が観察されるなど、この仮説と矛盾する実験結果もあり、はっきりしたことはわからないというところのようです。
・NMDA受容体拮抗薬であるメマンチンとの違いについては以下のように説明されています。グルタミン酸神経のシナプスにおけるシナプス小胞グルタミン酸の自発的放出は、微小シナプス電流(mEPSC)をもたらし、この微小シナプス電流は蛋白質合成を抑制する働きを有するとのことです。ケタミンはNMDA受容体遮断により微小シナプス電流を抑制し、蛋白質合成の抑制を解除し、海馬CA1領域におけるシナプス増強を促進するなどして、抗うつ作用をもたらすことを示唆する結果が得られています。一方でメマンチンは非競合的なNMDA受容体遮断薬であり、微小シナプス電流を抑制しないため、抗うつ作用を発揮しないのではないかと考えられているようです(Molecular Psychiatry vol. 23, 801–811 (2018))
・また樹状突起などのシナプス外にもGluN2Bサブユニットを含むNMDA受容体が存在しており、このGluN2B-NMDA受容体が活性化するとmTORシグナル経路を介して、シナプス恒常性維持に関与する蛋白質合成が抑制されるとのことです。ケタミンはこのNMDA受容体を阻害し、蛋白質合成の抑制を解除し、これもまた抗うつ作用の発揮に関わっているのではないかとの仮説もあります。ただし、GluN2B-NMDA受容体拮抗薬であるMK-0657は第2相試験で抗うつ作用を確認できなかったことから(JAMA psychiatry. 2016; 73(7):651–652.)、これもまたはっきりしたことはわかりません。
・その他、NMDA受容体とは別のイオンチャネル型グルタミン酸受容体であるAMPA受容体もまたケタミンの抗うつ作用に関与していると言われており、ケタミン投与によるGABA介在神経の抑制を介したグルタミン酸神経系の活性化はAMPA受容体の活性化をもたらし、抗うつ作用の発揮に関連するとの仮説もあります。またケタミンは海馬TrkBのリン酸化を介してBDNF合成を促進し、NMDA受容体遮断を介してeEF2K経路を阻害することにより蛋白質合成を促進するなどし、抗うつ作用に寄与するとの仮説もあるようです。
・はっきりしたことはよくわからないケタミンの抗うつ作用ですが、今回笑気(亜酸化窒素)による治療抵抗性うつ病に対する第2相試験の報告がなされました(Sci Transl Med. 2021 Jun 9;13(597):eabe1376. doi: 10.1126/scitranslmed.abe1376.)。これまたNMDA受容体遮断作用を有する薬剤による報告となります。このような麻酔作用、催幻覚作用を有する薬剤の臨床試験における問題点も最後にコメントしておきます。
治療抵抗性うつに対する亜酸化窒素背景
・大うつ病の生涯有病率は約10-20%と推測されており、そのうつ少なくとも1/3の患者が治療抵抗性と考えられている・2015年に20名の治療抵抗性うつ病の患者を対象とした概念実証試験(プラセボ対照クロスオーバー試験:Biol. Psychiatry 78, 10–18 (2015))では、1時間の50%亜酸化窒素(50%笑気/50%酸素)はプラセボ(50%二酸化窒素/50%酸素)吸入群と比較して、吸入2時間後にHAM-D21の亜酸化窒素群とプラセボ群の点差は-4.8点、24時間後には-5.5点であり、亜酸化窒素吸入群が有意に良好な結果となった。亜酸化窒素はNMDA受容体拮抗作用を有し、ケタミンと類似した作用機序により抗うつ作用を発揮する可能性がある
・しかし亜酸化窒素50%には嘔気、嘔吐などの副作用の懸念があり(2015年の試験では15%に出現)、今回、より低濃度の亜酸化窒素(25%亜酸化窒素)で有効性があるかどうか、副作用が少ないかどうか、さらに治療効果が24時間以上継続するか、少なくとも14日間追跡を行った
方法と対象
・18-75歳までの大うつ病患者
・MADRSで19点以上
・過去に3回以上の適切な用量・期間の抗うつ薬治療に反応しなかった経験があり、かつ現在のエピソードにおいて1回以上の抗うつ薬治療に反応していない患者
・パーソナリティ障害、パニック症、双極性障害、統合失調症圏、物質使用障害は除外
・試験開始4週間前から投薬内容の変更はなく、また試験開始後3か月間も抗うつ薬の用量や内容の変更は行わないこと
・プラセボ対照二重盲検クロスオーバー試験
・患者に対してランダムな順序で50%亜酸化窒素吸入セッション、25%亜酸化窒素吸入セッション、プラセボ(50%窒素/50%酸素)吸入セッションを各セッション1時間、セッションの間隔1か月間で施行された。精神症状などの評価は、吸入前、吸入後22-28時間、1週間後、2週間後に施行。
・主要評価項目はHAM-D21
結果
・28名がエントリー。うち20名が3回の吸入を完了。4名が1回の吸入を完了。解析はこの24名を対象に行われた・参加者の平均罹病期間17.5年。エントリー時点でのHAM-D21得点の中央値は20.5点、MADRS中央値は30点
・吸入2週後のHAM-D21は50%笑気吸入後、25%笑気吸入後いずれもプラセボよりも有意に良好。50%と25%の差は有意ではなかった。プラセボとの有意差は両群ともに2時間後および24時間後では有意ではなく、2週目で明らかな有意差がみられた
3回のセッション全て完了した20名について、ベースラインのHAM-D21得点中央値は20.5点であったが試験完了時には8.5点へと、有意にうつ症状が改善した。試験終了時には、20名中11名(55%)が反応群(HAM-D21で50%以上改善)となり、20名中8名(40%)が寛解(HAM-D21で7点以下)となった・亜酸化窒素による抗うつ作用は少なくとも2-4週間は継続する可能性がある
・副作用については、50%笑気ガス吸入後には嘔気21%、頭痛17%、めまい13%、笑い13%、離人感 26%などで、25%笑気ガス吸入後では嘔気5%、頭痛10%などであり、有意に50%亜酸化窒素吸入後の方が副作用が多かった
コメント・2015年の結果と比較して、治療効果の速効性は再現されませんでしたが、25%亜酸化窒素、50%亜酸化窒素ともに治療抵抗性うつ病患者に対してプラセボより有意な治療効果を示しました。3か月間での全体でのHAM-D21得点変化量は11点であり、抗うつ薬の臨床試験を上回る数値となりました。
・問題点としては、二重盲検試験でしたが、亜酸化窒素の鎮静作用により亜酸化窒素吸入か、プラセボであるかは5人中4人以上の患者で判別可能であった点で、これによるunblinding biasは混入しうることです。
・副作用が強い薬剤では起こりうることですが、被検者がこれにより実薬かプラセボかわかってしまい、盲検性が確保できず、それによるバイアスが混入しうる問題があります。これについてはエスケタミンなどの臨床試験でも同様のことがいえ、さらに三環系抗うつ薬など、古い向精神薬における臨床試験でも、このunblinding biasが結果に影響を与えた可能性を指摘する報告もあります(Holper and Hengartner BMC Psychiatry (2020) 20:437)。unblinding biasが混入しプラセボがプラセボとわかってしまうと、プラセボ反応率は低下します。当然治療薬の効果量は増します。このところの新規抗精神病薬のプラセボ反応率が上昇してきているのは、新規抗精神病薬の安全性が向上し、unblinding biasが混入しにくくなっていることも一因としてありうるのかもしれません。
-
認知症とうつ
2021年06月29日
・メタ解析においては抜け落ちてしまう情報もあります。時にそれが本質的に重要な情報である場合もあります
・下の図は2018年の認知症+うつに対する抗うつ薬の有効性についてのメタ解析(Cochrane Database Syst Rev. 2018 Aug 31;8)ですが、これだけみると、ああ、抗うつ薬効かないのか、という結論になります。
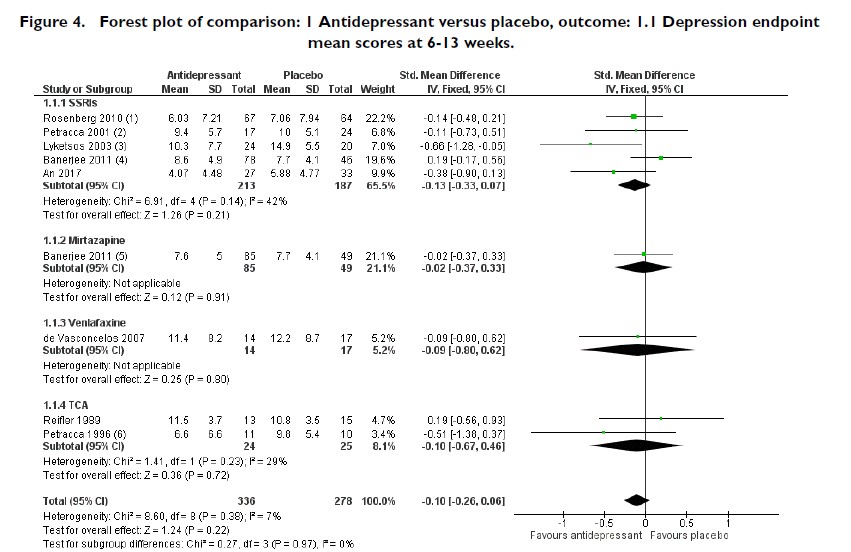
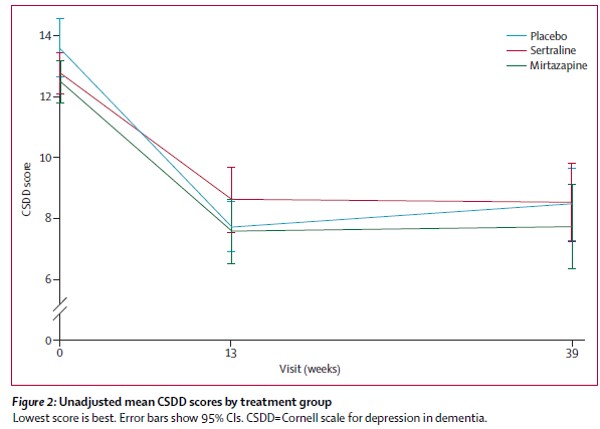
・しかし、元データをみると、より重要な情報が含まれていることがわかります。たとえばアルツハイマー型認知症のうつ症状に対するミルタザピンとセルトラリンのプラセボ対照比較試験(Lancet. 2011 Jul 30;378(9789):403-11 )でのCSDD(Cornell Scale for Depression in Dementia)の経時変化が以下です
・さらに別のアルツハイマー型認知症のうつ症状に対するセルトラリンのプラセボ対照比較試験(Am J Geriatr Psychiatry. 2010 Feb;18(2):136-45 )のCDSSの経時変化は以下となります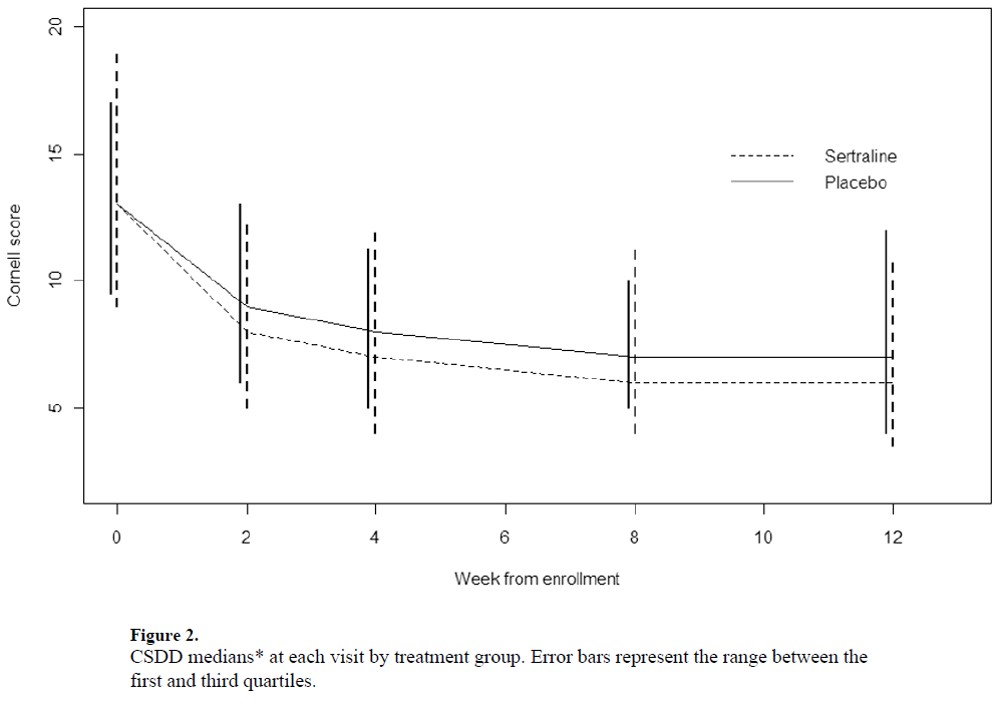
・これらのデータをみて、何がわかるでしょうか。それはプラセボが良く反応しているということです。そこから認知症のうつに対しては環境的介入が重要そう、ということが推測できます。このような情報はメタ解析からは読み取れません。・今回、このような観点から、環境的介入と薬物療法、通常ケアなどを比較したネットワークメタ解析の結果(文献1)が報告されたのでみてみます。結果として有効であると主張されている内容の一部にはネットワークメタ解析であるが故の脆弱なものも含まれており(わずかn=14の介入試験の結果が有効であると主張されているなど)、注意して解釈する必要があります。
・薬物療法による介入がぱっとしないことは予想できるのですが、いろんな手法の存在する非薬物療法的介入において、どれがよさそうか、についてはある程度知っておいてよさそうです。ただし薬物療法の場合の二重盲検試験と比較して、非薬物療法はよくてsingle blindなので、よりバイアスも入りやすく、質が異なるものを比較しているという点で注意が必要となります。
認知症とうつ(文献1)
背景
・認知症患者の約16%は大うつ病の診断を受け、32%は周辺症状として診断閾値下のうつ症状を経験している。
・認知症ではうつ症状は身体的症状(食欲不振、エネルギー低下など)や行動的症状(イライラ、社会的孤立、悲しみなど)として表出される
・認知症のうつ症状は、QOLの低下、機能低下、死亡リスクの増加などと関連し、介護者の苦痛、負担、抑うつの増加とも関連する
・認知症患者の大うつ病と抑うつの治療には、薬物療法(抗うつ薬、抗精神病薬など)および非薬物療法(回想法、運動療法など)が行われているが、抗うつ薬投与の有害性(転倒など)が報告され、非薬物療法の重要性が認識されている
・しかし、薬物と非薬物の効果を直接比較した無作為化試験はまれであり、エビデンスが乏しい。今回薬物療法と非薬物療法をネットワークメタ解析で比較した
方法と対象
・解析対象となったのは、認知症患者の周辺症状としてうつ症状を有する患者(非大うつ病)ないし認知症に大うつ病を合併する患者のうつ症状に対する薬物療法ないし非薬物療法についての無作為割付比較試験 N=235
・認知症周辺症状としてうつ症状を有する患者対象(非大うつ病)にした試験N=213
・認知症に大うつ病を合併する患者を対象にした試験 N=22
非薬物療法の介入内容としては以下のようなものに分類された(Nはnodeの数)
・通常ケア:患者のニーズと好みに基づいて、医療と社会的ケア(例:入浴などの日常生活動作のサポート)を適切に利用することと定義 N=102(非大うつ病)、N=6(大うつ病)
・アニマル・セラピー:動物と過ごすこと N=2(非大うつ病)
・経皮的電気刺激:経頭蓋的電気刺激 N=7(非大うつ病)
・回想法 N=26(非大うつ病)
・レクリエーション療法:ゲームや料理、読書など N=33(非大うつ病)
・リアリティー・オリエンテーション N=4(非大うつ病)
・心理療法:認知行動療法、カウンセリング、問題解決療法、力動的対人関係療法、支持的療法など N=24(非大うつ病)
・認知症患者へのサポート:当事者への電話や情報提供などによる心理社会的サポート N=1(非大うつ病)
・作業療法 N=15
・音楽療法 N=25
・多職種連携ケア:複数のヘルスケア専門家によるケアプランの作成 N=11(非大うつ病)、N=1(大うつ病)
・複数の感覚刺激:活動や物を通じて異なる感覚刺激を統合する N=5(非大うつ病)
・日常生活動作の修正 N=4(非大うつ病)
・マッサージとタッチセラピー:マッサージ、鍼治療など N=4(非大うつ病)、N=1(大うつ病)
・高照度光療法 N=4(非大うつ病)
・社会的交流:介護者やその他の人との交流 N=22(非大うつ病)
・運動:エアロビクス、バランストレーニング、レジスタンス運動など N=30(非大うつ病)、N=4(大うつ病)
・環境修正 N=3 (非大うつ病)
・介護者と当事者への教育 N=7(非大うつ病)
・介護者への教育 N=17(非大うつ病)、N=2(大うつ病)
・深部脳刺激 N=2(非大うつ病)
・認知リハビリテーション:治療目標を設定したリハビリテーション介入 N=27(非大うつ病)
・認知刺激療法:週に1-2回の認知機能賦活セッション(ゲームや芸術療法など) N=27(非大うつ病)
・介護者へのサポート N=3(非大うつ病)
・アロマテラピー N=2(非大うつ病)
非抗うつ薬系の薬物療法としては以下のnodeを設定
・抗菌薬:ドキシサイクリン+rifamin N=1(非大うつ病)
・降圧薬:nomidipine、プロプラノロール N=3(非大うつ病)
・抗精神病薬 N=21(非大うつ病)
・コリンエステラーゼ阻害薬 N=18(非大うつ病)
・dextromethorphan+キニジン N=1(非大うつ病)
・etanercept N=1(非大うつ病)
・ホルモン治療:エストロゲン、DDAVP、オキシトシン、プロゲステロン N=10(非大うつ病)
・高脂血症治療薬:アトルバスタチン N=1(非大うつ病)
・メマンチン N=6(非大うつ病)
・気分安定薬:カルバマゼピン、リチウム N=2(非大うつ病)
・プレドニゾロン N=1(非大うつ病)
・精神刺激剤:メチルフェニデート N=1(非大うつ病)
・鎮痛薬:アセトアミノフェン、オピオイド N=2(大うつ病)
抗うつ薬についてはN=15(非大うつ病)、N=18(大うつ病)
・評価尺度としては、Cornell Scale for Depression in Dementia(CSDD)がN=100、Geriatric Depression ScaleがN=58、Neuropsychiatric Inventory - DepressionがN=38など
・試験期間は11週未満がN=109(43%)、11-20週がN=78(30.5%)、21-30週がN=29(11%)、31週以上がN=40(16%)
・主要評価項目は、各試験使用されたうつ尺度の標準化平均差を求め、それをCSDD得点の平均変化量に変換したものを用いた
結果ネットワークメタ解析で有意差があった組み合わせは(かつnodeの試験の数が複数あるもの)以下の通り
。回想法は介護者支援より有意に良好 SMD 1.03
・回想法は認知リハビリテーションより有意に良好 SMD 0.42
・回想法は通常ケアより有意に良好 SMD 0.45
・認知刺激療法は回想法と有意差なし
・マッサージ+タッチセラピーは回想法より有意に良好 SMD 1.32
・認知刺激療法は介護者サポートより有意に良好 SMD 1.15
・認知刺激療法は認知リハビリテーションより有意に良好 SMD 0.53
・認知刺激療法は音楽療法より有意に良好 SMD 0.38
・認知刺激療法はプラセボと有意差なし
・認知刺激療法は心理療法と有意差なし
・認知刺激療法は通常ケアより有意に良好 SMD 0.57
・マッサージ+タッチセラピーは認知刺激療法より有意に良好 SMD 1.21
・マッサージ+タッチセラピーは作業療法より有意に良好 SMD 1.27
・作業療法は介護者サポートより有意に良好 SMD 1.07
・作業療法は通常ケアより有意に良好 SMD 0.51
・作業療法はプラセボとは有意差なし
・作業療法は介護者サポートより有意に良好 SMD 1.07
・作業療法は認知刺激療法と有意差なし
・多職種連携ケアは介護者サポートより有意に良好 SMD 0.96
・マッサージ+タッチセラピーは多職種連携ケアより有意に良好 SMD 1.38
・多職種連携ケアは通常ケアより有意に良好 SMD 0.39
・マッサージ+タッチセラピーはアニマルセラピーより有意に良好 SMD 1.32
・マッサージ+タッチセラピーは抗精神病薬より有意に良好 SMD 1.82
・マッサージ+タッチセラピーは高照度光療法より有意に良好 SMD 1.83
・マッサージ+タッチセラピーは抗うつ薬より有意に良好 SMD 1.76
・マッサージ+タッチセラピーは介護者教育より有意に良好 SMD 1.57
・マッサージ+タッチセラピーはコリンエステラーゼ阻害薬より有意に良好 SMD 1.52
・マッサージ+タッチセラピーは認知リハビリテーションより有意に良好 SMD 1.74
・マッサージ+タッチセラピーは運動より有意に良好 SMD 1.5
・マッサージ+タッチセラピーは多職種連携ケアより有意に良好 SMD 1.38
・マッサージ+タッチセラピーは音楽療法より有意に良好 SMD 1.58
・マッサージ+タッチセラピーは心理療法より有意に良好 SMD 1.55
・マッサージ+タッチセラピーは通常ケアより有意に良好 SMD 1.77
・Pairwiseのメタ解析結果で通常ケアと有意差があったのは運動療法 SMD 0.47
・非大うつ病患者において、ネットワークメタ解析で通常ケアと有意差があったのは、認知刺激療法 SMD 0.57、マッサージとタッチセラピー SMD 1.77、多職種連携ケア SMD 0.39、作業療法 SMD 0.51、回想法 SMD 0.45
・薬物による介入だけでは、通常のケアよりも有意に効果が高いものはなかった
・大うつ病患者においては、試験の異質性からネットワークメタ解析が施行できなかった。SSRI(sertraline、fluoxetine、citalopram、escitalopram)とプラセボの有効性を比較した7つのRCTについての結果は一定していない
・ミルタザピンおよびベンラファキシンもプラセボと比較してうつ病の症状の有意な改善とは関連していなかった
・1つの無作為化比較試験において、多職種連携ケアは通常の治療よりも効果的であることが報告されたが、他の非薬物介入(心理療法と運動)の効果を支持するエビデンスは不十分である
コメント・マッサージ+タッチセラピーについてはかなり高い効果量が出ていて違和感があるのですが、2つのグループから対通常ケアでの3つの介入試験(n=219)が報告されています。この3つの試験のRisk of Biasについては評価者のblindingおよびmissing dataの扱いいずれもlowとなっており、試験の質はそこまで低いとは言えないようです。ただ有効性についての結果が目立ちすぎているのは気になります。
・なお論文中で通常ケアと比較して有効とされた認知刺激療法+コリンエステラーゼ阻害剤、社会的交流+認知刺激療法+運動については、それぞれ1つの介入試験しかなく(特に後者はn=14のみ)、エビデンスの質としては低いため、結果からは除外しています
引用文献
文献1:Jennifer A Watt et al. BMJ 2021;372:n532 | doi: 10.1136/bmj.n532
-
Prof. Stefan Leuchtとのやりとり
2021年06月20日
・もともとはBMJで認知症のうつについてのネットワークメタ解析の論文(BMJ 2021;372:n532 | doi: 10.1136/bmj.n532)が出たので、それについて記事にしようかと思ったら、思いがけない方向にいってしまったので、まとめておきます。
・そもそもネットワークメタ解析については、いろんな批判もあり、以前も触れたようにバイアスの影響をとても受けやすいこと(Trinquart L et al. PLoS One. 2012;7(4):e35219. doi: 10.137)や、組み込まれた各試験のエビデンスの質がわかりにくく(この点、従来の直接比較のメタ解析のforest plotは、何本の介入試験が統合されているのかなどの情報が明示されるため、まだ直感的にわかりやすい)、結果の解釈には注意を要します。
・その点において、2020年の藤田医大の岸先生らの報告(Kishi T et al. Mol Psychiatry. 2020 Nov 11. doi: 10.1038/s41380-020-00946-6)にみられたようなConfidence in Network Meta-Analysis (CINeMA)を用いたgrade表記などは、ネットワークメタ解析における結果の信頼性を併記するという点で素晴らしいものだと思いました。
・ネットワークメタ解析の結果に注意すべき具体例を挙げると、例えば2011年のBMJ誌に掲載された全般不安症に対するネットワークメタ解析の論文(BMJ. 2011 Mar 11;342:d1199. doi: 10.1136/bmj.d1199.)があります。
・結果を見ると、やたらフルオキセチンの結果が良好で、有効性に関して第一位、フルオキセチンすばらしいという結論になっているのですが、いざその根拠となった論文をみてみると、フルオキセチンについてはたった1つだけの介入試験しかなく、しかもフルオキセチンの症例数は33例、さらにこの介入試験は大うつ病に全般不安症を合併した症例に対するベンラファキシンとの比較試験です(純粋に全般不安症の患者を対象としたものではない)。
・従来のメタ解析においては、このような単一の介入試験がメタ解析の対象として組み込まれることはないので、まずこのようなバイアスリスクの高い結果を主張するようなことは起こりません。この報告をみて一気にネットワークメタ解析への信頼感が薄れ、警戒心が高まりました。少なくともこの報告については、科学的に信頼に足る結果とはとてもいえません。しかも著明な雑誌にこのような結果が掲載されてしまうのですから、恐ろしいことです。ネットワークメタ解析の結果については批判的に吟味しなくてはならないのはこのような理由からです。
・ちなみに現段階でそこそこあてにすべき全般不安症のネットワークメタ解析の結果は、2019年のlancet(Slee A. et al. Lancet. 2019 Feb 23;393(10173):768-777)あたりでしょうか。2020年にもより解析対象を絞ったネットワークメタ解析(Kong W. et al. Front Pharmacol. 2020 Nov 11;11:580858.)が出ていますので、こちらもチェックしておきたいところです。
・そのような実例を勉強会で具体的な例で示そうと思い、ちょうど良いと思って、統合失調症のpredominant negative symptom症例に対する介入試験のメタ解析の報告(Mark Krause et al. Eur Arch Psychiatry Clin Neurosci. 2018 Oct;268(7):625-639.)を基に、いかに従来型のメタ解析とネットワークメタ解析が異なり注意が必要かについて示そうと思ったら、思いがけず、元論文の間違いではないかという点を見つけてしまい(結果的に間違いとは言えなかったのですが)、corresponding authorのLeucht教授(世界的に超有名な方です)にメールしたところ、思いがけず返信をいただいて、その内容に納得したところです。
・まず、この論文の主要な結果を示します。
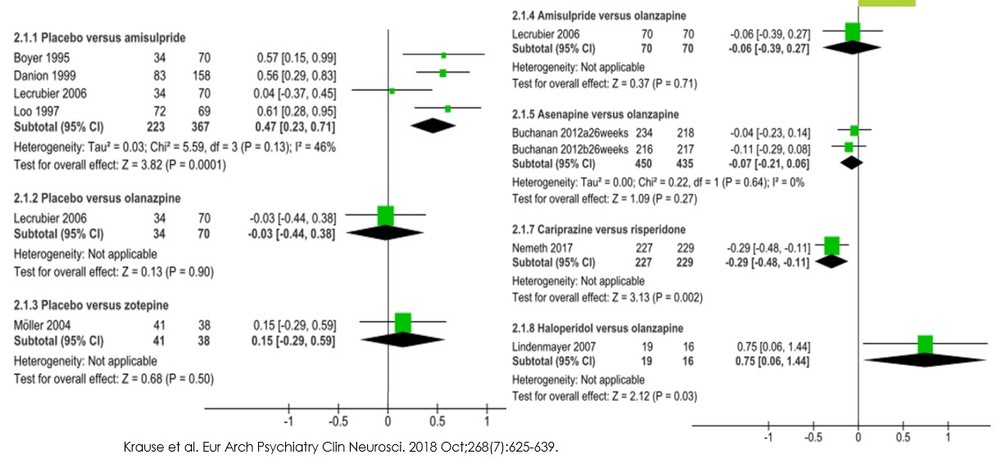
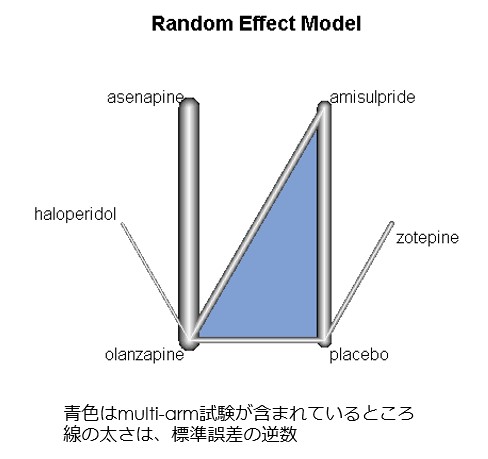
・この図でわかるように、メタ解析が可能なのはアミスルプリドくらいしかなく、他の薬剤については介入試験が1つか2つ程度しかないため、エビデンスは不十分であり、明確な結論を引き出すことができないことがわかります。直接比較のメタ解析では、このようなこともforest plotから読み取れるのでわかりやすいです。
・ところが、実際のところ、このようなデータしかなくても強引にネットワークメタ解析を施行することはできてしまいます。この点については、この論文の著者もネットワークメタ解析を当初行おうと思ったけども、結果のinconsistencyが大きく断念したと記載されています
・いざネットワークメタ解析をしようと思った場合、特にmulti-armsの介入試験の場合には元データから新たにデータを作り直す必要がある場合があるため、multi-armsの介入試験(この図ではLecrubier 2006にあたる)については元論文をあたって、元データを取り出して、そこからRでのネットワークメタ解析に使用できるデータに変換する必要があります。
・そこで元論文(Acta Psychiatr Scand 2006: 114: 319–327)を眺めてみたところ、主要評価項目はSANS summary scoreとなっています。結果はどうかというと、24週間でのベースラインからの変化量は、アミスルプリド群 -4.3点(SD 4.9)、オランザピン20mg群 -4.0点(SD 5.1)、オランザピン 5mg群-4.7点(SD 5.3)、プラセボ群 -3.1点(SD 4.8)とのことでした。ここから標準化平均差(SMD)を出すことは各群のnがわかれば手計算で簡単にできて、アミスルプリド群は0.237(SE 0.21)、オランザピン群は5mgと20mgをひとまとめにして、0.178(SE 0.209)となります、アミスルプリド群とオランザピン群とのSMDは-0.06(SE 0.169)となります。
・さて、Krauseらの論文とおんなじかなと思い確認したら、なんとこの論文ではアミスルプリドのSMD 0.04、オランザピンのSMD -0.03とあるではありませんか。この理由がどうしてもわからなくて、だめもとでLeucht教授にメールしてみました。そしたら思いがけず返信をいただいて驚愕しました。

・何度かやりとりをしたのですが、結論から言うと、Krauseらの論文では、主要評価項目としてPANSS negativeをまず第1に設定していて、その次にSANSなどとしており、どちらのデータもある場合にはPANSS negativeをとるということでした(Lecrubierらの論文の本文中にはPANSS negativeの数値がないのですが、おそらくどこからかデータをもってこられたのでしょう)。あらかじめ設定したルールに従って解析したということです。
・ただ陰性症状の評価尺度としてはSANSの方が優れているので、この点は確かに議論の対象となりうることだとメールにありました。Leucht教授は精神医学の分野におけるEBMにおいては世界トップクラスの業績を上げておられ、極めて重要な論文も数多く公表されおられる大先生で、お忙しい中このような日本の片田舎の一臨床医の質問にも丁寧にお答えいただき実にありがたいことでした。
・というわけで私は、SANSを使って勝手にネットワークメタ解析を進めたわけですが、その結果は以下となります。(いつものようにRのnetmetaパッケージを使って、頻度論によるネットワークメタ解析をしています)
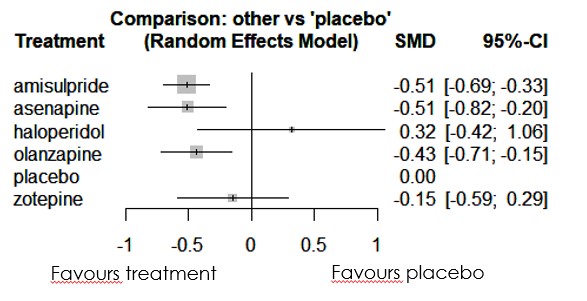

・このような解析をしてはいけませんよという注意喚起でやってみたネットワークメタ解析ですが、なにやら面白そうな結果がでてしまいました。Meiji SeikaファルマのMRさんが喜ぶかもしれない結果ですが、この結果も先に述べたようにエビデンスの質という観点から注意して解釈いただくことが必要となります(規模はまあまあ大きく、異質性も小さいのですが、アセナピンについては1つのグループだけからの2つの介入試験の結果から構成された結果のため)。
・ちなみにKrauseらのデータによるNMAでは問題となったinconsistencyの問題ですが、Lecrubierらの論文に関してSANSを使用すると、inconsistencyは問題なく、異質性に関する指標I^2についてもQ^het=0.343, d.f.=3から0となり(ネットワークメタ解析では、I^2=max((Q-d.f.)/Q,0)で決定するため)問題がない状況に落ち着いています。
・この結果にpartial agonistがどう食い込んでくるのかなど、今後注目すべき事柄となります。
-
抗うつ薬と心理療法
2021年06月08日
・5月号のJAMA Psychiatry誌に、完全または部分寛解状態にあるうつ病患者について、抗うつ薬をそのまま継続した場合と、抗うつ薬を減量し、そこに予防的心理療法を行う場合とで、平均15か月間での予後がどのように異なるかについてのメタ解析結果が報告されました(文献1)。
・結論は予想通りで、再発リスクに関して有意差なしというものでした。
・結論が予想できた背景には、2015年のBMJ誌の報告(文献2)の知見があります。まずはこの内容からみていきます
大うつ病に対する第2世代抗うつ薬とCBTの有効性比較(文献2)
背景
・毎年アメリカ人の7%が大うつ病に罹患し、治療を求めるのはその約半分といわれている
・さらに治療を受けた患者の20%ほどしか適切な治療を受けていないといわれる(薬物療法では、最低2ヶ月間の適切な薬剤による薬物療法と4回以上の診察、精神療法では、少なくとも1回30分以上で合計8回以上の専門家による精神療法施行)
・薬物療法では第2世代抗うつ薬(SSRI、SNRI、その他)が最も多く処方されている。2011年のメタ解析(Gartlehner G, et al. Ann Intern Med 2011;155:772-85)では、これら薬剤間で、有効性に関して有意な差はないとされている(注:より新しいメタ解析(文献3)やCANMATガイドライン(これについては文献3の影響などを大きく受けたものではありますが)については、ここでは明示しませんが一部の抗うつ薬が、別の抗うつ薬に対して有意に治療効果が優れている可能性が報告されています)
・今回、うつ病エピソードに対する初期治療としての、第2世代抗うつ薬とCBTの有効性の比較を行った
対象と方法
・18歳以上の大うつ病性障害患者
・第2世代抗うつ薬(ブプロピオン、シタロプラム、デスベンラファキシン、デュロキセチン、フルオキセチン、エスシタロプラム、フルボキサミン、レボミルナシプラン、ミルタザピン、ネファゾドン、パロキセチン、セルトラリン、トラゾドン、ベンラファキシン、ヴィラゾドン、ボルチオキセチンのいずれか)とCBTを直接比較したRCT
・11 RCTs(n=1511)
・HAM-D17で16-23点以上
結果
寛解率
・3つのRCTが寛解率を評価(n=432、寛解はHAM-D17で7点以下ないし7点未満で定義)
・試験期間は12-16週
・抗うつ薬群とCBT群で有意差はなかったが、数値的には抗うつ薬群が寛解率が高かった(47.9%対40.7%、risk ratio 0.98, 95% CI 0.73-1.32)
反応率
・5つのRCTが反応率を評価(n=660)
・試験期間は8-16週
・反応はHAM-D17 50% 以上の改善で定義
・反応率は抗うつ薬とCBTで有意差なし(44.2% 対 45.5%; risk ratio 0.91, 95% CI:0.77 - 1.07)
HAM-D変化量
・HAM-D変化量の差を2つのRCT(n=249)が報告・試験期間は8週間
・平均変化量の差( 0.38, 95% CI:2.87 to 2.10 )は有意差なし
長期経過
・2つのstudyが長期経過を報告
・1つは論理療法(rational emotive therapy:認知行動療法と治療的枠組みはほぼ同一)ないし認知療法と第2世代抗うつ薬を比較したもの。
・6ヶ月時点ではHAM-D17得点は精神療法群で有意に抗うつ薬群よりも低かった。寛解率や反応率は有意差なし
・もう1つは問題解決療法と第2世代抗うつ薬を比較したもので、1年時点での寛解率は問題解決療法群で高く、一方反応率は抗うつ薬群で高かった(いずれも有意差なし)
再燃率
・再燃率をみたものが1つ
・初期治療として、認知療法ないし第2世代抗うつ薬を使用し、最初1年間再燃がなかった群をさらにもう1年間フォロー
・初期治療として認知療法を受けた群の再発率は24%、抗うつ薬群は52%で、症例数が少なく有意差はなし(p=0.06)
中断率
・4つのstudyで評価。あらゆる理由による中断率は有意差なし(risk ratio=1.00)
・ただし副作用による中断は抗うつ薬群で多かった(有意差はなし)
・有効性欠如による中断についても有意差なし
抗うつ薬単独対抗うつ薬+CBTの比較
・3つのstudyあり。いずれも反応率、寛解率において有意差なし
・1つのstudyではMADRSの変化量において、併用群が有意に抗うつ薬単独群よりも大きな変化量を示したとの結論が得られている(しかしこのstudyはbiasが大きいという問題が指摘されている)
結論
・現在までに行われた11の直接比較のRCTによれば、大うつ病に対する初期治療として抗うつ薬がCBTよりも有意に優れているとの証拠はない。
・ただし、この結論はサンプルサイズが小さいことや、現段階ではエビデンスの質が低いことにより、決定的なものではない
・また、両者併用が抗うつ薬単独よりも優れていることを積極的に支持するエビデンスもなく、今後の検証が必要
・重症度により結論が変化する可能性があり(重症群ではそもそも初期からの精神療法的介入そのものが困難)、検証する必要あり
・以上の現状により、日本うつ病学会のガイドラインでもこの報告は引用されていない(しかし無視できる報告でもない)
・この報告が今後の検証においても正しいままであった場合、軽度~中等症のうつ病(HAM-D17で18点程度まで)においても、第1選択としてCBT単独として行うことは選択肢として除外できない、ということになる
うつ病再発予防における抗うつ薬と心理療法(文献1)
背景
・APA2010やNICE2009などのガイドラインでは、再発リスクの高い患者に対して、寛解後少なくとも2年間の維持療法として抗うつ薬を継続することが推奨されている(日本うつ病学会のガイドラインでもAPA2010を引用し、同様の記載となっている)
・抗うつ薬は副作用、安全性の問題や、漸減時に再発リスクが高まることが指摘されている
・うつ病の再発予防のための、心理学的介入(予防的認知療法、マインドフルネス・ベースド・コグニティブ・セラピー[MBCT]、ウェルビーイング・セラピーなど)を抗うつ薬の投与後に順次行うことも選択肢である。
・これらの介入は、抗うつ薬単独と比較して、抗うつ薬との併用で特に治療効果が高く、急性期治療後に抗うつ薬に追加することで、抗うつ薬単独よりも、より再発予防に効果的であることが報告されている(再発のリスク比 0.84で有意差あり。JAMA Psychiatry.2021;78(3):261-269.)
・しかし、どのような患者に対して抗うつ薬を漸減するのか、あるいは継続するのがよいかについてのエビデンスはない。
・再発うつ病の場合、治療効果に関連する修飾因子や予測因子を特定する試みがこれまでに報告されている。
・うつ病の再発リスクと関連する要因としては、以下のようなものが検討されている。発症時の年齢と過去のエピソードの数、成人(小児では関連なし)では初発エピソードの重症度、成人での(小児では関連なし)共存する他の精神病理(特に気分障害)の存在、うつ病や他の気分障害の家族歴(すべての年齢)は再発リスクの増加に関係、さらにネガティブな認知、神経症傾向が高いこと、社会的支援の不足、ストレスの多いライフイベントなども再発リスクとされている。一方で性別、社会経済的地位、配偶者の有無は、うつ病の再発の危険因子ではなさそうとされた(Clin Psychol Rev. 2007;27(8):959-985)
・その他、小児期の感情的なネグレクト、心理的虐待(Acta Psychiatr. Scand. 126, 198?207)、慢性疼痛や慢性疾患( BMC Psychiatr. 14, 1?9.)、残遺うつ症状(Behav Cogn Psychother.2019;47(5):514-529.)なども再発リスク因子として報告されている
・しかしメタ解析による結果は、全体を総括した結果であり、患者の個別性に応じた治療法の最適化に関する情報は得られない
・今回、Individual participant data meta-analysis(IPDMA)を用いて、抗うつ薬の漸減中または漸減後に心理学的介入を順次行うことが、抗うつ薬単独投与の代替となるかどうか、またどのようなケースに有効かを検証した
方法と対象
・完全または部分的に寛解しているうつ病患者(18~65歳)
・抗うつ薬漸減しながら予防的心理療法を行う場合と抗うつ薬単剤療法を比較した無作為割付比較試験 N=4 (n=714)
・平均追跡期間15カ月
・抗うつ薬継続群 n=369、抗うつ薬漸減ないし中止+マインドフルネスに基づく認知療法併用(n=287)、抗うつ薬漸減ないし中止+予防的認知療法(n=58)
・共変量として年齢、うつ病発症年齢、婚姻状態、治療セッションへの参加回数、性別、共存する精神疾患の有無、過去のうつ病エピソードの回数、学歴、寛解月数、HAM-Dで測定したベースラインの残存抑うつ症状を抽出
結果
・対象者の平均うつ病エピソード回数 5.6回。すべての参加者は寛解状態で、うつ病寛解得点を定義した試験は4つのうち2つで1つがHAM-Dで7点以下、1つは10点以下。寛解期間は6-8か月(1つは未定義)
・ランダム効果モデルでは、抗うつ薬漸減ないし中止+精神療法の抗うつ薬継続に対する再発のハザード比は0.86(95%CI,0.60-1.23)で有意差なし
・再発リスクに有意に関連した共変量としては、寛解月数、発症年齢、ベースラインの残存うつ症状であった
・これらリスク因子を有する場合でも、(例えばうつ病の残存症状が強く、過去のエピソード回数が多くても)、抗うつ薬漸減+心理療法により、再発のリスクの有意な上昇はみられなかった
結論
・うつ病の臨床的予後因子にかかわらず、抗うつ薬の漸減中および漸減後に心理療法を併用することにより再発リスクの上昇を防ぐことができる可能性があるコメント
・再発予防のために用いられた心理療法の大半がマインドフルネスに基づくもの(対象症例の83.2%)であったのは印象的でした。いわゆる第2世代の定型的な認知行動療法であればどうなのかについての結論もほしいと思いました(たぶん結論は変わりませんが)
文献1:Josefien J.F. Breedvelt et al. JAMA Psychiatry. 2021 May 19. doi: 10.1001/jamapsychiatry.2021.0823. Online ahead of print.
文献2:Halle R Amick et al. BMJ. 2015 Dec 8;351:h6019. doi: 10.1136/bmj.h6019.
文献3:Cipriani A et al. Lancet. 2018 Apr 7;391(10128):1357-1366 -
統合失調症の再発予防について
2021年05月25日
・最新のlancet psychiatry誌に2回以上のエピソードを有する(初発ではない)統合失調症ないし統合失調感情障害患者を対象とした、維持療法における介入試験について、中央値52週間程度の期間において、標準用量を維持した方がいいのか、それとも低用量(標準用量の下限の50-99%の用量)でも大丈夫なのか?を検証したメタ解析が公表されました(文献1)。少しつっこみどころがあるので、コメントしてみます
・まず、この論文のアブストラクトの結論をみて、なんとなく違和感を感じたのですが、そう感じた背景にWunderinkらの2013年の論文(文献2)や、藤田医大の岸先生の2019年の論文(文献3)が頭にあったことがあります。この2つの論文はいずれも初発精神病が対象となっている点で今回の報告(非初発)とは性質が異なりますが、その結論は重要です。
・文献2では、初発精神病後の最初の2年間で抗精神病薬の減量ないし中断を試みた群は、維持療法を行った群(無作為割付オープン試験)と比較して、最初2年間での再発率は2倍になるものの、その後さらに5年間経過観察したところ、7年予後(症状的および機能的寛解の割合)は当初減量/中断群に割り付けされた群では40.4%、維持群では17.6%であり、長期予後の観点からは減量を目指したほうがいいという結果でした。
・また文献3では、初発精神病エピソード後2年間の抗精神病薬の維持療法は、中断した場合と比較して、有意に(最初1年間で約50%程度)再発リスクを減少させるということで、抗精神病薬を維持することの重要性がわかるものでした。しかし1年間抗精神病薬を中断した患者の45.7%(18-24か月間では39.4%)は再発しなかったということで、一定の割合で抗精神病薬を中止しても再発しない患者群が存在していたということになります。今後の研究で重要なことは、どのようなケースにおいて抗精神病薬を中止可能なのかを個別に見極める指標を同定することになります
・最新のBAPガイドライン(文献4)では初発エピソード後2年間の抗精神病薬継続を推奨していますが、維持療法期間を決定する際には、患者と共同で抗精神病薬継続および中断のリスクとベネフィットについて検討し、決定することとされています。その上で、”The nature of the index episode (including speed of onset, insight, severity, and risk) can be helpful in assessing the risks associated with any future relapse”とされています。この括弧内最後のriskとは遺伝負因や一般的な再発リスクのことでしょうか?BAPガイドラインでは再発の予測因子として、服薬アドヒアランスの悪さ、男性であること、DUPが長いこと、病前の社会機能の悪さ、ベースラインでの陰性症状の重症度、物質使用障害の併存、治療者との治療関係の希薄さ、患者とその家族や介護者との間の相互作用の希薄さ、ライフイベントや家族の高感情表出(high EE)などが挙げられていますが、これら指標が果たして治療中断後にも再発リスクが高いことと関連するかどうかについては明確な結論はでていません。
・そんなわけで文献1のアブストラクトを読んで生じた違和感は、文献2や3の結論は初発エピソードについてとはいえ、今回のようにメタ解析でおしなべてしまうと、抗精神病薬を減量することにより利益を享受しうる一群の存在や、あるいは減量ないし中断可能な一群を抽出し、個別化医療を提供しようとする望ましい方向性への努力がどこかにいってしまうのではないかという懸念が浮かんだことに起因します。まずは文献1の内容をざっとまとめ、その後独自に行った解析結果では、結論がまた異なることをみてみます。
再発を繰り返す統合失調症再発予防のための抗精神病薬用量
背景
・統合失調症の維持療法期間において、急性期における抗精神病薬の継続はプラセボと比較して1年後の再発リスクを有意に減らすことが報告されている(リスク比 0.40 :Lancet 2012; 379: 2063–71.)・維持療法における最適な抗精神病薬の用量については、急性期治療で寛解に至った抗精神病薬の用量を維持することを推奨するものもあれば、効果的な最低用量の維持療法を推奨するものもあり一定しない。
・2013年以降のガイドラインで、維持療法期の抗精神病薬の用量について言及されている7つのガイドラインについて、最新のBAPガイドラインでは、維持療法期間においては、認可された範囲内の用量の抗精神病薬を継続して使用する必要があり、減量に際しては再発のリスクが高まることを考慮して、慎重かつ綿密にモニターすべきであるとしている。他6つは減量ないし低用量投与戦略を部分的に支持するとの結論になっている(例えばMausleyガイドライン2018では初発後の維持療法では慎重な減量も選択肢となっている。WFSBP2013も初発エピソード後では低用量(CP換算600mg未満)での再発予防も可能かもしれないとしている。またRANZCP2016は体重増加などの副作用発現時には変薬ないし減量を考慮すべきとなっている)
・BAPガイドラインが他6つのガイドラインと比較して、維持療法期間における減量について慎重な記載となっている理由は、Huiらの報告(Lancet Psychiatry 5:432–442.2018)の影響がある(初発エピソード後の抗精神病薬の早期(3年以内)の減量ないし中止が10年予後を悪化させていたとの報告)
・2013年から2019年までのガイドラインに影響を与えた論文にWunderinkらの報告がある(JAMA Psychiatry 2013; 70: 913–20. )。この論文では、初発精神病患者については、最初2年間で減量ないし中断を試みた場合、維持療法を行った場合と比較(無作為割付オープン試験)して、最初2年間での再発率は約2倍(減量/中断群 43%対維持群21%)になるものの、その後さらに5年間(合計7年間)オープンで経過観察したところ、7年後に症状的および機能的寛解(リカバリー)を達成した患者の割合は当初減量/中断群に割り振られた患者では40.4%、維持群では17.6%と、リカバリー率が約2倍であったことが報告された。そのため初発精神病後の減量ないし中断を目指す治療戦略は長期予後の改善を目指す上で有用かもしれないとされた。
・しかしこの論文については批判があり、有意差はないものの、ベースラインの診断が統合失調症であったものが減量/中断群では38.5%に対して維持群では52.4%、週16時間以上の労働への従事率が減量/中断群では50.8%に対して維持群では38.1%であったこと(BAPガイドラインでの批判)、オープン試験であったための結果の信頼性への問題などが指摘されている
・Uchidaら(Schizophr Bull 2011; 37: 788–99)の2009年までに公表された13試験のメタ解析において、統合失調症の再発予防における標準用量(オランザピンでは5-15mg(n=48)、クエチアピン600mg(n=52)、ジプラシドン60mgないし160mg(n=135),リスペリドンLAI 50mg/2w(n=161)、他9個の試験のうち7つは第1世代LAI(n=320:フルフェナジン decanoate、ハロペリドール decanoateなど)。残る2つは第1世代(n=23))と低用量(定義の1日用量50~100%、クエチアピン300mg(n=41)、ジプラシドン40mg(n=72)、リスペリドンLAI 25mg/2w(n=162)など)または超低用量(定義の1日用量50%未満:オランザピン1mg(n=14)を除いて全て第1世代LAI(n=172)の報告)の有効性を比較し、低用量治療は標準用量治療と比較して、入院、再発のいずれにおいても有意な差はなかったと報告した。
・一方で標準用量対超低用量については、入院、再発いずれも超低用量群が有意に増加したが、ほぼ第1世代LAIの結果であり、エントリーされた各試験の不均質性も大きいことから、結果の信頼性は低いとされている
・今回、2009年以降の第2世代抗精神病薬およびLAIの結果も含めて、統合失調症の維持療法における用量減量ないし標準用量の再発リスクや治療中断率などの比較を行った
対象と方法
・18歳以上の統合失調症ないし統合失調感情障害を対象とした24週以上無作為割付比較試験
・ベースラインで安定しており、抗精神病薬の2つの用量(標準用量ないし低用量または超低用量)で比較したもの
・初発精神病ないし治療抵抗性統合失調症は除外
・International Consensus Study of Antipsychotic Dosingが定義する急性期治療において推奨される用量の範囲内を標準用量、標準用量の下限の50-99%までを低用量、下限の50%未満を超低用量とした
・ジプラシドン、アセナピン、フルフェナジン decanoate N=6、オランザピン N=6、アリピプラゾールLAI,ハロペリドール decanoate N=2、オランザピンpamoate、ハロペリドール、propericiazine、ピモジド、スルピリド、リスペリドン N=4、クエチアピン
・主要評価項目は再発およびあらゆる理由による中断
・副次評価項目は、入院、忍容性不良による中断、PANSS変化量、体重、プロラクチン濃度、錐体外路症状得点など
・22 studies(24 trials、n=3282)。18 trialsが二重盲検、6 trialsがオープンないしsingle blind。22 studiesのうちバイアスリスクがlowと判断されたのは2つ。ハイリスクは 3つ。
・標準用量群 n=1777、低用量群 n=726、超低用量群 n=779
・参加者年齢中央値 38歳。試験期間の中央値は52週間
結果
・標準用量と比較して、低用量は再発リスクが44%有意に増加(RR=1.44 95% CI 1.10-1.87)。あらゆる理由による中断は12%有意に増加(CI 1.03-1.22)
・標準用量と比較して、第1世代低用量群は有意に再発リスクは増加(RR 2.08、95% CI 1.49-2.90 )、第2世代抗精神病薬低用量群は有意差なし(RR 1.23 CI 0.88-1.70)
・標準用量と比較して、低用量LAI群は、有意に再発リスク増加(RR 2.13 CI 1.44-3.14)、経口低用量抗精神病薬は有意差なし(RR 1.29、CI 0.96-1.72)
・標準用量と比較して、第1世代低用量群は有意にあらゆる理由による中断リスクは増加(RR 1.34、95% CI 1.11-1.63 )、第2世代抗精神病薬低用量群は有意差なし(RR 1.07 CI 0.97-1.18)
・標準用量と比較して、低用量LAI群は、あらゆる理由による中断リスクは有意差に増加(RR 1.35 CI 1.09-1.66)、経口低用量抗精神病薬は有意差なし(RR 1.08、CI 0.98-1.18)
・標準用量と比較して、超低用量では、再発リスクが72%(RR 1.72、95%CI 1.29-2.29)増加、あらゆる理由に中断リスクが31%(RR 1.31、1.11-1.54)増加。
・標準用量と比較して、第一世代超低用量群は有意に再発リスク増加(RR 1.55, 95%CI 1.06-2.28)、第二世代超低用量群においても再発リスクは有意に増加(RR 1.88, 1.22-2.90)
・標準用量と比較して、超低用量LAIは再発リスクを有意に増加( RR 1.94, 1.25-3.01 )、超低用量経口薬も再発リスクは有意に増加(RR 1.35, 1.08-1.69)
・標準用量と比較して、あらゆる理由による中断は、第一世代超低用量群では有意差なし(RR 1.14, 95%CI 0.93-1.39 )、第2世代超低用量群とは有意差あり(RR 1.38, 1.11-1.72)
・標準用量と比較して、超低用量LAIのあらゆる理由による中断率は有意差あり(RR 1.39, 1.06-1.81 )。超低用量の経口剤も有意差あり(RR 1.20, 1.04-1.38)
標準的な用量と比較して、低用量は総精神病理スコア(PANSSないしBPRS)の増加と有意に関連した(SMD 0.17、95%CI 0.03 -0.31)
入院、忍容性不良による中止、抗コリン剤の使用、錐体外路症状得点は群間で有意差なし結論
・再発歴を有する統合失調症ないし統合失調感情障害患者においては、標準用量を維持した方が、約1年後の再発率やあらゆる理由による中断率は、減量するよりも良好な可能性がある(エントリーされた試験の中央値52週、最長104週)。それ以上の長期予後についてはわからない。第2世代抗精神病薬については低用量でも標準用量と比較して再発率や中断率に有意差はでていない(数値的にはやや悪かったが)
コメント
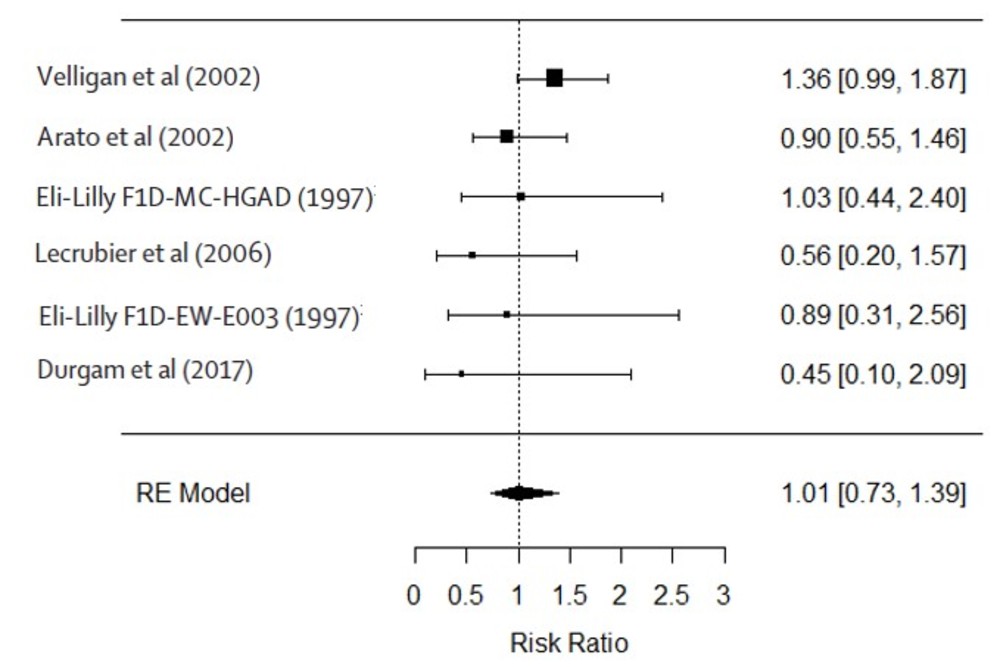
・結果の部分で低用量第2世代抗精神病薬と標準用量との再発リスクなどの比較が、低用量第2世代抗精神病薬対標準用量第2世代抗精神病薬なのか、低用量第2世代抗精神病薬対標準用量全体なのか(おそらく前者ですが)、よくわからなかったので自分でメタ解析をしてみました。
・この論文では二重盲検試験とsingle blind試験、オープン試験全ての結果をメタ解析対象として(図では二重盲検試験だけの結果も提示してありますが)いますが、とりあえず経口第2世代抗精神病薬の二重盲検試験だけを解析対象とし、標準用量対低用量について再発リスクのrisk ratioについてrandom effect modelでメタ解析をしてみます(いつものようにRのmetaforパッケージでやります)。
・コードはこんな感じです(試験のラベルはめんどくさいので入れてません。図のラベルは後付けです)
a <- c(21,2,4,5,5,48)
n1 <- c(68,31,31,16,64,88)
c <- c(23,6,12,14,9,35)
n0 <- c(67,42,83,46,64,87)
dat <- data.frame(a,n1,c,n0)
library(metafor)
dat.escalc <- escalc(measure="RR", ai=a, n1i=n1, ci=c, n2i=n0, data=dat)
res.reml <- rma.uni(yi, vi, method="REML", data=dat.escalc)
forest(res.reml, order = "prec", transf = exp, refline = 1)・そうすると、下図のように、結論は支持されず、経口第2世代抗精神病薬では、低用量でも標準用量と比較して再発リスクはそうかわらないRR=1.01(CI 0.73-1.39)となりました。どう解釈すればいいでしょうか?
文献1:Mikkel Højlund et al. Lancet Psychiatry. 2021 Jun;8(6):471-486.
文献2:JAMA Psychiatry 2013; 70: 913–20.
文献3:Kishi T. et al. Psychol Med. 2019 Apr;49(5):772-779
文献4:Re Barnes T. et al. J Psychopharmacol. 2020 Jan;34(1):3-78.




