-
ベンゾジアゼピン中止のメリット
2020年12月15日
・ベンゾジアゼピン系薬剤を長期使用した後に中止することのメリットがあるのかどうか。その点についてアセスメントした報告を3つほど眺めてみます。
・文献1はベンゾジアゼピンを中止した場合と中止できなかった場合とで転倒頻度を比較したものです。
・文献2はベンゾジアゼピンおよびZ-drugsを中止した場合と継続した場合とで睡眠の質やQOLについて比較した介入試験の結果です
・文献3はベンゾジアゼピン系睡眠薬を中止した場合に認知機能にどのような影響があるかを評価した試験です。
・3つのうち2つはオープン試験であり試験の質としては高いものではありませんが、その結論は重要といえます。
ベンゾジアゼピン中止と転倒リスク(文献1)
背景
・ベンゾジアゼピン長期使用は高齢者における転倒リスクの増加につながることが報告されている。
・フランスは2007年に高齢者向けにベンゾジアゼピン中止のためのガイドラインを作成した。漸減法や代替療法、CBT併用による減量などが提案された
・今回ナーシングホームにおける1年間のベンゾジアゼピン中止プログラム実施と転倒数の変化について観察を行った
方法と対象
・2011年から2013年にかけて108名の入所するナーシングホームにおいて行われた・対象は少なくとも1種類のベンゾジアゼピン系薬剤を投与されている患者
・重度の不安を有する患者は除外
・長期ないし高用量投与患者については、4-10週間ないしそれ以上かけての漸減が行われた。1週間当たり25%の減量が推奨されたが、患者ごとに現実的な減量ペースが設定された。長時間作用型であれば短時間作用型に置換するなどの方法もとられた
・対象者に対しては、ベンゾジアゼピン長期使用の有害性などの教育が行われた
・転倒回数については、ベンゾジアゼピン減量開始前半年間(T1期間)、およびベンゾジアゼピン中止後半年間(T2期間)、記録された
結果
・2011年9月の段階で108名中28.7%(31名)がベンゾジアゼピンを処方中であり、平均年齢は89歳であった。その全員が1か月以上処方されており、27名は半年以上処方されていた。また20名は中時間ないし長時間作用型ベンゾジアゼピンであり、11名は短時間作用型ないしZ-drugsを処方されていた
・1年間で完全なベンゾジアゼピン中断を完遂できたのは31名中11名(35.5%)であった
・T1期間(ベンゾジアゼピン減量開始前半年間)中の転倒頻度については、ベンゾジアゼピン離脱を完遂した患者群と、非完遂群において2.1回±1.3回(非完遂群)、2.3回±0.6回(完遂群)で有意差なし
・一方で、ベンゾジアゼピン離脱完遂群についてはT2期間(ベンゾジアゼピン中止後半年間)において転倒数は0.5±0.2回と有意に減少した。非完遂群は有意差なし
結論
・ベンゾジアゼピンからの完全な離脱はなかなか困難であるが、中止できた場合、高齢者にとっては転倒リスクの有意な減少をもたらしうるため中止が望ましいといえそう
高齢原発性不眠症患者のゾピクロン、ゾルピデム、テマゼパム長期使用からの離脱の影響(文献2)
背景
・ベンゾジアゼピンないしベンゾジアゼピン関連薬剤(ベンゾ系薬剤)は不眠に対して短期間の使用が推奨されているが、長期使用されることはしばしばである
・高齢者に対するベンゾ系薬剤の使用はふらつきや転倒、認知機能障害などの原因となりうる
・フィンランドでは2009年に、ベンゾ系薬剤の販売量は、1000人当たり51.4DDD (defined daily doses)であり、そのうち90%がゾピクロン、ゾルピデム、テマゼパムで占められていた
・長期使用後のベンゾ系薬剤の中断は、不眠や不安の悪化などの反跳症状を伴うことがあり、これらの症状出現は個人差が大きく、使用していた薬剤の用量や期間、併存症などの影響を受ける
・長期ベンゾ系薬剤からの離脱が、高齢者のQOLや睡眠にどのような影響を及ぼすかについての介入試験は少ない
・今回離脱6か月後に睡眠ないしQOLがどのように変化するか、離脱群と非離脱群で比較してみた
方法
・ベンゾジアゼピン系薬剤離脱に対するメラトニン2mg置換の有効性についての介入試験の一部
・もともとの介入試験は、被検者をメラトニン2mg群とプラセボ群に無作為割付し、1か月間経過をみたもので、被検者は1週間に50%ずつそれまで内服していたベンゾ系薬剤を漸減するようにアドバイスされた(強制ではない)。減量に抵抗感の強いものやもともと高用量(2DDD以上)使用者は25%ずつ減量。結果的にはメラトニンの離脱症状予防効果は明らかではなく、ベンゾ系薬剤からの離脱率はメラトニン群 67%、プラセボ群 85%で、ベンゾ離脱補助薬としてのメラトニンの効果は否定的であった。
・今回はさらにそこから5か月間(トータルで6か月間)、二重盲検のままで経過をみたもの
・参加者は55歳以上で、1か月以上毎晩ゾルピデム、ゾピクロンないしテマゼパムを睡眠薬として使用中のもの(大半が1年以上)で、原発性不眠症患者(DSM-IV)。そのほかの睡眠薬やベンゾ、向精神薬を内服中は除外。10本以上/日の喫煙者も除外
・被検者はベースライン時点で睡眠衛生についての指導を実施
・1か月後に血中濃度を測定し、離脱成功者は70名、非成功者は20名。その後5か月後に再度血中濃度を測定し、ベンゾ系薬剤の使用から離脱を継続できているかどうかを確認。最終的に離脱に成功していた群と、失敗した群とでQOL(VAS)、睡眠状況(the Basic Nordic Sleep Questionnaire(BNSQ))を質問紙で確認
結果
・1か月時点で離脱成功者70名のうちで、6か月後も離脱に成功していたのは30名、36名は不定期的にベンゾ系薬剤使用、3名は定期的にベンゾ系薬剤使用、1か月時点で離脱非成功者20名のうち、6か月後に離脱に成功したのは4名、不定期的使用が8名、定期的使用は6名。トータルで6か月時点での離脱成功者は34名、離脱非成功者は55名
・6か月時点での睡眠潜時は、離脱成功者で有意に短かった。ベースラインの睡眠潜時が30分以上の割合は離脱成功者で52%であったが6か月後に24%まで減少。非成功者では52%から51%と高いまま。つまり中止すると睡眠潜時が有意に改善する可能性がある
・QOLについては1か月後、6か月後で群間の有意差はなかったが、離脱群の方が数値的に良好であり、1か月後からベースラインと比較して有意差を示した。
・総睡眠時間は6か月時点でベースラインとの差なし、群間有意差なし。うつ尺度なども有意差なし
結論
・高齢の原発性不眠症患者においては、ゾピクロンやゾルピデムを使い続けるよりも、中止した方が、もともとの入眠潜時が30分を超えている場合は、寝つきが良くなる可能性があり、さらにQOLも改善する可能性がある
・ただし自己評価式なので、ベンゾをやめられたかどうか、自分でわかっているため、バイアスが入る可能性がある
高齢者のベンゾジアゼピン系睡眠薬からの離脱の効果(文献3)
背景
・2003年時点でイギリスの65歳以上の15%が睡眠薬を定期的に内服しているといわれている。そのうち80%がベンゾジアゼピン系薬剤といわれている。4週間を超えた処方は控えるように言われているが、繰り返し処方されている現実がある
・高齢者に対するベンゾは認知機能への悪影響などが報告されており、今回は、ベンゾジアゼピン系薬剤からの離脱が認知機能などへどのように影響するかを調べた
対象と方法
・イギリスでの多施設無作為割付試験
・65歳以上で6か月以上ベンゾジアゼピン系睡眠薬を内服中の患者、かつ睡眠薬をやめたいと希望した者(介入群)。および対照群(C群)として睡眠薬を継続したものを設定
・ベンゾ中断希望者をAとBの2群に無作為割付。A群は開始後よりベンゾを漸減し、8-9週で中断。B群は3か月間継続し、その後漸減を開始し、開始20週後で中断
・12週後の検査はA群とB群の比較で、中断後数週後の認知機能の比較、52週後はA群+B群(中断群)とC群(継続群)との比較でベンゾ中止後32週以上後の認知機能などの比較となる
結果
・12週時点(A群が中断して3-4週後)での認知機能についてはA群、B群で群間有意差なし
・52週後の認知機能(map search、reaction time in speed of information processing、total digit span、単純反応時間)については中断群(A群+B群)と継続群(C群)とで有意差あり。中断群において一部認知機能が継続群より有意に良好であった
・睡眠については睡眠日誌でアセスメントされ、12週後において睡眠時間や中途覚醒時間、入眠困難などはA群とB群で有意差なし。52週後の中断群(A群+B群)と継続群C群との比較では、睡眠に関する問題などにおいて有意差なし
・睡眠薬を継続していても、中断しても、睡眠に関する指標は有意差なかった。このことは睡眠薬を継続することの意味が有意なものがないことを示唆している
結論
・ベンゾジアゼピン長期使用後に中断すると、その後すぐには有意な変化はないが、半年くらいたってから認知機能はやや改善する可能性があり。また睡眠状態については、やめても継続しても睡眠日誌では有意な差がなかった。このことは睡眠薬(テマゼパムやニトラゼパム)を長期継続した場合に、耐性が形成され、効果がなくなっている可能性があることを示唆している。
まとめ
・ベンゾ系薬剤を長期使用していると、離脱症状により中断しにくくなりますが、耐性が形成されその効果がほとんど無くなっている可能性もあります。中止できた場合には利益がある可能性もありますので、漸減中止を目指す意義があります。
引用文献
文献1:Javelot H et al. Pharmacy (Basel). 2018 Apr 6;6(2):30. doi: 10.3390/pharmacy6020030.
文献2:Ritva Lähteenmäki et al. Basic Clin Pharmacol Toxicol. 2019 Mar;124(3):330-340.
文献3:H V Curran , R Collins, S Fletcher, S C Y Kee, B Woods, S Iliffe Psychol Med. 2003 Oct;33(7):1223-37. doi: 10.1017/s0033291703008213当ブログ記事に関して、御意見、御批判、間違いの御指摘などありましたら sekitoblogアットマークgmail.comまでご連絡いただけますとありがたいです。ただし個別の健康相談には対応いたしかねますのでご了承ください。
-
ベンゾジアゼピン系薬剤の問題点など
2020年12月08日
・なかなかまとめる機会がなかったのですが、ベンゾジアゼピン系薬剤(とZ drugs)を中心とした睡眠薬の問題点をまとめておきます。今回は主に問題点についてで次回はベンゾジアゼピン系薬剤を中止した場合の利点などについて2回にわけてまとめます。
・問題点については文献1を中心にまとめます
交通事故リスクについて
・交通事故リスクについては、走行テストにおけるSDLP(standardized deviation of lateral position)によりある程度定量化できます。・これは、定速走行中に側線に沿って運転したときの車体の側線からのずれの標準偏差(SDLP)を指標とするものです。
・実際の走行テストではサーキットを95km/時の定速で100km(約1時間)走行します。被検者は走行する際に視線の右側に点線で描かれた境界線と一定の距離をとって、点線に沿って走行するように指示され、この点線からのずれの標準偏差が走行中の左右のぶれの指標となります。血中アルコール濃度0.05%時のSDLPが2.4cm程度とされており、プラセボ群との比較におけるSDLP値が2.4cm以上の場合に、自動車運転能力において臨床的に問題となると考えられています。
・2009年のRapoportらのメタ解析(J Clin Psychiatry.2009;70(5):663–73.)では、前夜にジアゼパム等価換算5mg以下のベンゾジアゼピン内服後の翌朝の運転では対照群との比較においてSDLPの差のSMDが0.80(SDLPに換算して+2.7cm程度)との報告がなされています。また10mgをこえるとSMDは3.07となり、用量依存性の運転コントロール喪失のリスクが報告されています。
・またZ-drugについても報告があり、zopiclone内服後11時間のSDLPの障害があり、この状態は血中アルコール濃度0.8mg/Lに相当し、交通事故リスクが2倍になると報告されています。
・International Council on Alcohol, Drugs and Traffic Safety (ICADTS) は薬剤を三段階にランク付けしており、Iがほぼ安全、IIが軽度から中等度の障害、IIIが重度の障害とされ、22種類のベンゾジアゼピン系薬剤およびzopicloneがIIIにランク付け、zolpidemとzaleplonがIIにランク付けされています。
・ラメルテオンについても健常者を対象としたSDLPの報告(SLEEP 2011;34(10):1327-1334)があり、8mg内服8時間半後に実施された運転テストではプラセボと比較してSDLP+2.2cmとプラセボ投与期間と比較して有意な増加を示しました。また運転試験後に実施された認知機能テストなどにおいても反応時間の有意な延長などの影響が報告されています。筋弛緩作用がないためか、内服1時間半後に実施されたバランステストではプラセボ投与期間と比較して有意な悪化はみられませんでした。
・スボレキサントについては、健常者を対象とした報告があり(Sleep. 2015 Nov 1;38(11):1803-13.)、スボレキサント20mg投与後翌日の運転試験でのSDLPのプラセボとの差は+1.01cm(統計的有意差あり)、投与9日目のSDLPは0.48cm(有意差なし)と報告されています。
・レンボレキサントについては、健常者を対象とした第1相試験の結果(Sleep. 2019 Apr 1;42(4):zsy260)によると、レンボレキサント単回投与後(2日目朝)および反復投与開始9日目朝におけるプラセボ群との平均SDLP値の比較について、いずれも統計的有意差は認められず、投与翌日におけるプラセボ群に対する平均SDLP値の差は、レンボレキサント2.5mg群0.02cm、レンボレキサント5mg群0.23cm、レンボレキサント10mg群0.73cm、反復投与開始9日目におけるプラセボ群に対する平均SDLP値の差は、レンボレキサント2.5mg群0.48cm、レンボレキサント5mg群0.36cm、レンボレキサント10mg群0.74cmと報告されています。
・これらの結果は、主に健常者を対象としたデータによるものでした。
・では、ベンゾジアゼピン系薬剤を慢性に内服している人ではどうか?その結果を報告した論文(Hum Psychopharmacol. 2019 Nov;34(6):e2715)によると、週に4日以上少なくとも半年以上ベンゾジアゼピン系薬剤を内服している人(全て免許取得後3年以上で年間500km以上運転している人)について、内服継続期間が半年以上3年未満の場合、午前11時から午後3時までに開始された走行テストにおけるSDLPは対照群と比較して平均+4.56cm(N=9:ロラゼパム1mg、ゾルピデム10mg、テマゼパム20mg、ロルメタゼパム2mgなど標準的な摂取量。ただし抗うつ薬など併用薬剤はあり)。一方で内服継続期間が3年以上の群(N=23)ではSDLPは対照群と比較して+0.70cmとなりました(同じく抗うつ薬などの併用薬剤は各種あり)。
・これは長期服用により耐性がついたためとも考えられますが、両群ともに各種認知機能検査においては対照群と比較して有意な悪化を示していました。
・半年以上3年未満の服用期間におけるこのSDLPの数字はアルコール血中濃度0.08%以上0.1%未満に相当する数字であり、酒気帯び運転の基準は大幅に超えている状況ですので、常に酔っぱらったような状態で運転しているともいえます。
・この結果については、併用薬剤の影響や疾病そのものによる影響を除外できていない可能性もありますが、漫然とベンゾジアゼピン系薬剤を継続することのリスクといえます。
・ちなみにアルコールとベンゾジアゼピンを同時に摂取してしまうと、交通事故リスクが約7.7倍になるとのメタ解析の報告があります(Drug Saf. 2011 Feb 1;34(2):125-56.)
・以上SDLPの結果をざっと記載しましたが、一点注意点があります。
・SDLPの平均値での比較だけでは、現実的には安心できないという点です。
・例えば、スボレキサントについては、投与2日目にSDLP平均+1.01cmとなっていますが、あくまで平均であり、20mg投与群28名中6名がSDLPのプラセボ群との差が2.4cmを超えていたことも報告されています(Sleep. 2015 Nov 1;38(11):1803-13.)
・従って、どの程度持ち越しの影響があるかについては個別に注意すべきということになります。
・また以前にも当ブログ記事で触れましたが、ベンゾジアゼピン系薬剤、スボレキサント、レンボレキサントについてはCYP3A4により主に代謝されるため、クラリスロマイシン、イトラコナゾール、グレープフルーツなどCYP3A4阻害作用を有する物質との併用は、作用が増強される恐れがあるため注意となります(クラリスロマイシン、イトラコナゾールなどはスボレキサントと併用禁忌。レンボレキサントは併用注意で禁忌ではない)
転倒、骨折リスク
・Khongらの2012年の14のstudyのメタ解析(Calcif Tissue Int.2012;91(1):24–31)では、骨折のリスクはベンゾジアゼピン使用により24-58%増加するとしています。・2014年のXingらのメタ解析(25 studies:Osteoporos Int. 2014;25(1):105–20.)でもベンゾジアゼピン使用により13-30%の骨折リスク増加が報告されています。この解析では、同時に短時間作用型においてよりリスクが高かったことが報告されています(ただしこれについてはバイアスの可能性があり、転倒リスクが高い患者に短時間作用型を好んで処方する傾向などが影響している可能性があるとされています)。
・投与開始後1-2週間の転倒リスクが特に高く、また高用量とリスク増加は関連があるとされています。
・Z-drugと骨折リスクについては報告が少ないものの、Parkらが2016年に報告したもの(Osteoporos Int. 2016;27(10):2935–44.)によると、9つstudiesのメタ解析の結果、zolpidemによる骨折リスクは92%増加するとされ、このリスク増加は、ベンゾジアゼピン系薬剤による骨折リスクを上回るものでした
その他のリスクについて
・ベンゾジアゼピン系薬剤の長期内服と認知症リスクとの関連を指摘する観察研究(Neuroepidemiology. 2016;. doi:10.1159/000454881.など)もあります。
・しかし方法論的限界があり、交絡因子(ベンゾジアゼピン系薬剤を使用せざるを得ない基礎疾患の存在と認知症発症との関連など)が除去できない問題もあります。
・また発症早期の認知症症状においてもまず最初にベンゾジアゼピン系薬剤が投与されることがしばしばあるとの指摘もあります。
・そこで文献1では、疫学研究においてある要因Aがある疾患Bの発症に関連するかどうか評価する際に用いられる判定基準であるBradford-hill criteriaを用いて、ベンゾジアゼピン系薬剤とリスクとの関連性についてのエビデンスをまとめています。
・Bradford-hill criteriaとは、以下の8項目で要因と疾患との関連性を評価するものです
(1)関連の一貫性(consistency):要因Aと疾患Bとの関連が異なった地域、集団、時間でも一貫してえられるか
(2)関連の強固性(strength):要因Aに暴露された群の疾患Bの発症率が、非暴露群に比べてどの程度高いか
(3)関連の時間性(temporality):要因Aへの暴露があって、その後疾患Bが発生しているか
(4)生物学的説得性(specificity):要因Aが疾患Bを招くという説得性のある形態学的、機能的な説明ができるか
(5)量反応関係(dose-response):関連の強固性を補強するもので、疾患Bの罹患 率の大きさが要因Aの暴露量(期間、強さ、量)によって変化するか
(6)現時点の知識との整合性(coherence):発見された要因Aと疾患Bの関連性は現在一般的に認められている疾患史や経過と矛盾しないか
(7)実験的証拠(experimental evidence):要因Aと疾患Bの関連について実験でえられた証拠があるか
(8)類似性(analogy):要因Aと疾患Bの関連性に、既に認められている因果関係でよく似たものがあるか・その結果が次図となります
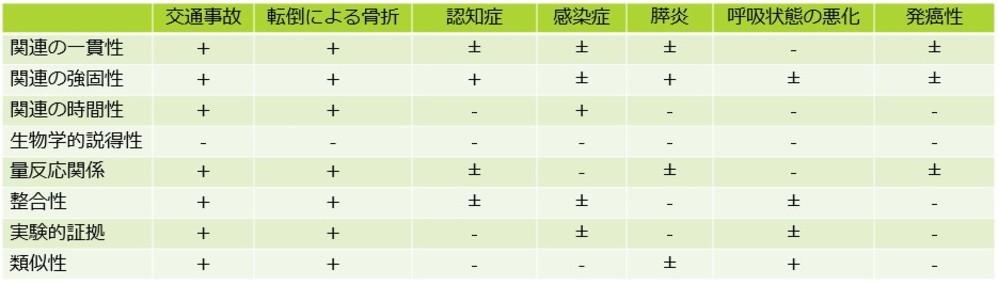
・ベンゾジアゼピンと交通事故や転倒による骨折との関連はほぼ確かであるものの、認知症との関連については、現段階でのエビデンスでは不明確ということがいえます。文献1)Jaden Brandt , Christine Leong, Drugs R D. 2017 Dec;17(4):493-507. doi: 10.1007/s40268-017-0207-
-
CYP遺伝子多型と向精神薬
2020年12月01日
・11月25日付JAMA Psychiarty誌にCYP2D6とCYP2C19の遺伝子多型に関連して、活性型に応じてどの程度曝露量(時間ー濃度曲線のAUCなどで定義)が異なるかについてのメタ解析結果が公表されていましたので(文献4)、まとめておきます。いくつか臨床的にも注意すべき結果があります。本文中何故か誤植が何カ所か残ってたりして気になりましたが
・ゴーシェ病治療薬のサテルガ(グルコシルセラミド合成酵素阻害薬)については、投与前にCYP2D6遺伝子型を確認し、CYP2D6遺伝子多型が通常活性型(EM:Extensive Metabolizer)ないし中活性型(IM:Intermediate Metabolizer)の場合に投与可能とされています。CYP2D6遺伝子多型検査は保険収載されておらず、CYP2D6遺伝子多型検査を先進医療として実施している医療機関もあります。
・またタモキシフェンはCYP2D6で代謝され抗腫瘍作用を発揮するため、日本人の約6割を占めるIM群では、用量調整が必要ではないかと考察されています(文献1)
・以前の記事でも触れましたが、CYP2D6、CYP2C19に関しては、各酵素の代謝活性に応じて低活性型:PM(Poor Metabolizer)、中活性型:IM(Intermediate Metabolizer)、通常活性型:EM(Extensive Metabolizer)、超高活性型:UM(Ultra-Rapid Metabolizer)に分類されています。
・日本人におけるCYP2D6およびCYP2C19の各活性型の頻度については次の通りです。
・CYP2D6の単一遺伝子変異の解析結果によれば,日本人にはCYP2D6*1 (42.3%)、*2(9.2%),*5(6.1%),*10(40.8%)などが検出されており(文献2)、活性型の頻度はPMは*5/*5で1%未満、IMは*1/*10、*2/*10、*5/*10、*10/*10であり、日本人では50-60%程度、EMは*1/*1、*1/*2、*1/*5、*2/*2、*2/*5であり40%程度と報告されています。
・日本人のCYP2C19のPMと推定される遺伝子型は,3種類(*2/*2,*2/*3,および*3/*3)が確認され,これらの遺伝子型の頻度の合計は18.8%とPMの頻度(約20%)に近いことから、これらの遺伝子型がPMの大半を説明しうるとされています(文献3)。通常活性型(EM)は*1/*1で30-40% 中活性型(IM)は*1/*2ないし*1/*3で40-50%程度と報告されています。
CYP2C19およびCYP2D6の活性型と抗うつ薬および抗精神病薬曝露量の関係について
背景
・向精神薬の有効性は不十分であるが、新規薬剤の開発はなかなか早急にはのぞめないので、現在使用しうる薬剤について、その用量を最適化することが重要である
・薬物の代謝能力は個々人で異なるが、最近のメタ解析では、抗精神病薬や抗うつ薬の効果用量関係において、至適用量が存在することが指摘されており、効果を最大化するためには最適な用量を用いることが重要である。
・最近の5000名以上の患者からのデータの解析結果によると、エスシタロプラム10mg、セルトラリン100mg、リスペリドン4mg、アリピプラゾール20mgで治療した場合、1/3以上の患者において、治療至適血中濃度域を外れた血中濃度になっていることが報告されている。
・CYP2D6およびCYP2C19はその代謝活性に応じて低活性型:PM(Poor Metabolizer)、中活性型:IM(Intermediate Metabolizer)、通常活性型:NM(Normal metabolizers=Extensive Metabolizer)、超高活性型:UM(Ultra-Rapid Metabolizer)に分類されている
・PMとIMでは、血中濃度が上昇しやすく、副作用が起こりやすいといわれている。一方でPMとUMではより治療の失敗につながりやすく、1年以内での変薬につながりやすいことが指摘されている
・抗精神病薬や抗うつ薬の用量設定については、CYP多型による活性型の違いを考慮していない。PMでは治療上投与さるる用量がNMよりも低用量にすべきと考えられ、FDAや欧州医薬品局、DPWG(Dutch Pharmacogenetics Working Group)などではアリピプラゾールについてCYP2D6のPM群では用量を低く設定することを推奨している。
・しかし実際にどの程度用量を減量すればよいのかについては、十分なデータがない。そこで今回これまでの報告についてsystematic reviewとメタ解析を行った
方法と対象
・抗うつ薬と抗精神病薬(エスシタロプラム、セルトラリン、フルオキセチン、フルボキサミン、パロキセチン、ノルトリプチリン、ミアンセリン、ミルタザピン、クロザピン、クエチアピン、オランザピン、リスペリドン、アリピプラゾール、ハロペリドール)が投与された試験について、被検者のCYP2D6とCYP2C19の遺伝子型(1%以上の頻度を有するもの)が解析されており、NM、IM、PMに分類されていること。
・各活性型で3名以上の被検者が存在すること。薬物曝露量が、(a)用量により正規化された定常状態の血漿中濃度、(b)用量により正規化された時間-血漿中濃度曲線の面積、(c)薬物の総クリアランス量の逆数、のいずれかによって測定されているもの
・各薬剤について、PM群、IM群、もしくはPM群+IM群について、各群の平均薬物曝露量をNM群の平均薬物曝露量で割って平均比率(RoM)を抽出した。これによりPM群ないしIM群ないしPM群+IM群がNM群の何倍薬剤に曝露されたかの指標が得られる
結果
・94 studies(N=8379 )が解析対象となった
CYP2D6遺伝子多型と薬物曝露の関係
・CYP2D6遺伝子型による分類で、NM群との差が比較的大きかったものとして、アリピプラゾールはPM+IM群対NM群のRoMは1.48(CI 1.41-1.57)と有意差あり。ハロペリドールはPM群対NM群でRoMは1.68(CI 1.40-2.02)と有意差あり。リスペリドンはPM+IM群対NM群のRoMは1.36(CI 1.28-1.44)と有意差あり。パロキセチンはIM対NM群でRoMは3.50(CI 2.52-4.85)(ただしわずか3 studies、N=41と小規模の結果)と有意差あり。
・NM群との差がより小さかったものとしては、CYP2D6遺伝子型による分類で、ハロペリドールはIM群対NM群でRoMは1.14(CI 1.05-1.25)。ベンラファキシンはIM+PM群対NM群でRoM 1.19(CI 1.09-1.29)
・その他Nは少ないものの有意差がみられたものとして、クエチアピンではPM群対NM群でRoM 1.32(CI 1.10-1.58 N=198, 1 study)、ミルタザピンではIM群対NM群のRoM 1.39 (CI 1.23-1.57)、パロキセチンではPM群対NM群でRoM 5.13(CI 3.82-6.87 N=73, 2 studies)などとなった
CYP2C19遺伝子多型と薬物曝露の関係
・エスシタロプラムではPM群対NM群のRoM 2.63(CI 2.40-2.89)、セルトラリンではIM群対NM群のRoM 1.38(CI 1.27-1.51)、エスシタロプラムについては、IM群対NM群のRoMは統計的有意差なし
・その他studyが2以下で有意差がみられたものとして、クロザピンではPM群対NM群のRoM 1.92(CI 1.32-2.79 N=78, 2 studies)、セルトラリンではPM群対NM群のRoM 2.70(CI 2.15-3.39, N=577, 2 studies)、ベンラファキシンではIM群対NM群のRoM 1.19(CI 1.11-1.31、N=669, 1 study)、ベンラファキシンのPM群対NM群のRoM 2.13(CI 1.54-2.93 N=443, 1 study)
まとめ
・アリピプラゾールについてはCYP2D6遺伝子多型において日本人で約半数を占めるIM群においてNM群と比較して曝露量が約50%多くなる可能性がある。
・クロザピンについては、CYP2C19遺伝子多型において日本人で約20%存在するPM群においてNM群と比較して曝露量が2倍になる可能性がある
・ハロペリドールについては日本人はPM群が1%以下と少ないため、CYP2D6遺伝子多型による曝露量の違いはあまり気にしなくてもよさそう
・リスペリドンはCYP2D6遺伝子多型において日本人の約半数を占めるIM群において曝露量が30%程度多くなる可能性がある
・エスシタロプラムはCYP2C19遺伝子多型において、日本人で約20%存在するPM群においてNM群と比較して曝露量が約2.6倍になる可能性がある。日本人の約半数のIM群はNM群と比較して曝露量が40%近く多くなる可能性がある
・ミルタザピンについては、CYP2D6遺伝子多型において、日本人で約半数を占めるIM群において、NM群と比較して曝露量が1.5倍になる可能性がある
・パロキセチンについてはNが少ないものの、CYP2D6遺伝子多型において日本人の約半数を占めるIM群において曝露量が約3.5倍になる可能性がある
・セルトラリンについては、CYP2C19遺伝子多型において、日本人で約20%存在するPM群においてNM群と比較して曝露量が2.7倍になる可能性がある。約半数を占めるIM群においてはNM群と比較して曝露量が40%近く多くなる可能性がある
・ベンラファキシンについてはCYP2D6遺伝子多型の影響をあまり受けないようである(20%未満)
コメント
・パロキセチンとエスシタロプラムのCYP2C19のPM群(日本人の約20%)におけるRoMの大きさが気になるところです。エスシタロプラムは用量依存性にQT延長をきたしうるので、特に高齢者において要注意かもしれません。
文献1)Ota T. et al. Int J Med Sci. 2015 Jan 1;12(1):78-82. doi: 10.7150/ijms.10263. eCollection 2015.
文献2)立石智則 心電図 2006:26 :201-210
文献3)久保田隆廣ら 薬物動態 2001:16(2):69-73
文献4)Milosavljevic F. et al. JAMA Psychiatry. 2020 Nov 25. doi: 10.1001/jamapsychiatry.2020.3643. Online ahead of print. -
リスク評価ツールは自殺リスクを予測しうるか
2020年11月24日
・結論から言えばNOですし、リスク評価ツールをそのように使用してはならないというのがNICEガイドラインなどの説くところですが、今回はちょうど12月号のlancet psychiatryにこれと関連した話題(文献2)も出たので、このあたりの話をまとめておきます。
・まずは文献1のリスク評価ツールの自殺関連事象(自殺企図+自殺既遂)の陽性的中率についてです
・文献1では自殺リスク評価ツールを第1世代から第3世代までに分類しています。第1世代は慣用的なBeck Hopelessness Scale(BHS)やBeck Depression Inventory (BDI)など。第2世代は髄液中の5-HIAAなどの生物学的指標。第3世代は統計学的に作成された指標(Manchester Self-Harm Rule (MSHR), Edinburgh Risk Rating Scale (ERRS)など)とのことです。
・この統計学的に作成された指標とはなんぞやということですが、文献3がわかりやすく、あらかじめ自傷行為で入院した患者を対象に、その後一定期間観察研究を行い、自傷行為再発のリスク因子を複数抽出し、因子毎にオッズ比に応じて重みづけしスコアリングするものです。例えば文献3のThe Repeated Episodes of Self-Harm (RESH) scoreでは、性別や年齢、手段、診断など多数の因子の中から、ロジスティック回帰分析により自傷行為再発に関して有意な因子として抽出された、これまでの自傷行為回数、エピソード間の間隔、最近12か月間の精神科診断、最近12月間の入院歴の4つの因子について、それぞれをオッズ比で重みづけをし、スコアリングするというシンプルなわかりやすい指標となっています。
リスク評価ツールの陽性的中率(文献1)
背景
・臨床家はどのような患者が自殺で死亡するのか、あるいは自傷行為を繰り返すのかを予測したいと考えている
・多くのリスク評価ツールがあり、例えばBeck Depression Inventory(BDI)やSADPERSONSスケールなどの心理学的尺度(第1世代)、デキサメタゾン抑制試験(DST)や髄液中5-ヒドロキシインドール酢酸(5-HIAA)濃度などの生物学的検査(第2世代)、ReACT自傷行為ルールやRESHスコアなどの統計モデルに基づいた尺度(第3世代)などが提唱されている。
・しかしこれらの尺度による予測精度は不正確であり、NICEガイドラインでは、将来の自殺や自傷行為を予測するためにリスク評価ツールを使用しないことを推奨しており、これらツールの使用を、リスク評価目的ではなく、患者にどのようなケアが適切かのニーズ評価目的として使用するように推奨している。
・リスク評価ツールの陽性的中率についてメタ解析を行ってみた
対象と方法
・縦断的コホート研究を解析対象とした。
・自殺のリスク評価について心理学的尺度ないし生物学的尺度ないし第3世代尺度を用いるもので、ハイリスク患者を同定し、追跡期間中の自殺関連事象(自傷行為や自殺既遂)をアウトカムとして評価しているもの
・70 studies(52が心理学的尺度、17が生物学的尺度、1つが両方)。成人が43 studies、思春期のみが4 studies、両方が9 studies。
・多くが最近の自傷行為ないし希死念慮を有する患者を対象(37 studies)としたもの、精神疾患患者を対象としたものが 29 studies、その他が4 studies。精神疾患を対象としたもののうちわけは気分障害が12 studies、初発精神病ないし統合失調症が3 studies、PTSDが1 study、退役軍人が2 studies、囚人が2 studies。
・追跡期間は6か月以下(18 studies)、10年以上が5 studies、1年が最頻で 19 studies
結果
・心理学的尺度については全体のpooled positive predictive value(PPV:陽性的中率)は自傷行為+自殺で38.9%、自傷行為のみが27.5%、自殺が3.7%
・生物学的尺度については、自傷行為のみのPPVが14.7%、自殺のPPVが14.5%
・第3世代尺度については自傷行為ないし自殺のPPVが38.7%
・自殺に関して最も良好なPPVは髄液中 5-HIAAであり、PPVが21.1%であった
・個別の心理尺度で自傷行為または自傷行為+自殺のPPVが最も高かったのはBeck Hopelessness ScaleとBuglass and Horton Scaleで,29.1%,28.8%と同程度であった。第三世代尺度の中で自殺+自傷行為のPPVが最も高かったのはエジンバラリスク評価尺度(Edinburgh Risk Rating Scale)であり,27.6%であった
・陽性尤度比は感度/(1-特異度)で表され、1に近い数値の場合、その検査は臨床的に意義がなく、10以上だと臨床的に有用とされている。
・自傷行為で受診した患者の12か月間の自傷行為再発率として16.3%を採用し、これを検査前確率とすると、 Beck Hopelessness ScaleとBuglass and Horton Scaleの陽性尤度比は2.1、第3世代尺度についての陽性尤度比は3.3程度となり、心理学的尺度の陽性尤度比は2から3程度であり、検査としての臨床的有用性は乏しいと言える
コメント
・自殺に関して髄液中5-HIAAの陽性的中率が21.1%というのはかなり高いように思えますが、引用文献をみると1980年くらいから2000年くらいまでの古い研究が大半で最近の報告がないのが気になるところです。
イギリスでの自殺リスク評価(文献2)
背景
・イギリスでの自殺者数は毎年約6000人でありここ10年間増加傾向にある
・自殺者の4人に1人以上が最近の精神保健サービスへの接触歴があることが報告されている
・リスク管理が重要であり様々なリスク評価のツールが使用されている。しかし自殺リスク評価ツールの自殺予測に関する有用性のエビデンスは限られている
・リスク評価ツールの予測能力には大きな差があり、臨床での使用が推奨されるほど診断精度で十分な結果が得られているものはない
・イギリス、オーストラリア、ニュージーランドのガイドラインでは、評価ツールを自殺関連リスクを評価するために使用することや、治療決定するために使用することを推奨していない。その代わり、個々のニーズとリスクの包括的な心理社会的評価を行い、治療計画を伝えるべきとされる。
一方でアメリカなど一部の国では、リスクの層別化と評価手法の普及を提唱している。・リスク評価ツールの使用についての大規模研究は少なく、現場レベルでの評価ツール使用についての経験的知識に関する研究も限られている
・今回、イギリスにおいて精神保健サービスの現場でどのリスク評価ツールが使用されているか、またそれらがどのように評価され、改善される可能性があるかについて調べた
対象と方法
・リスク評価ツールについてのレビュー、オンライン調査、臨床家へのインタビューを行った
・使用しているリスク評価ツールについては、イギリス85カ所の国民保健サービス(NHS)拠点に対して調査を行った。
・オンライン調査では、臨床家やサービスの利用者(患者)、支援者らが対象となり、臨床家に対しては評価ツールをどのように見て、どのように使用しているか、評価ツールを使用するためにどのようなトレーニングを受けているかなどを尋ねた。患者や支援者に対しては評価の経験やツールへの認識などを尋ね、全員に対してリスク評価ツールの改善点についての意見を求めた
・臨床家への電話インタビューについては、精神保健サービスを受診してから12ヵ月以内に自殺で死亡した人が登録されているNCISHデータベースを使用し、2015年1月1日から2015年12月31日までの間に自殺で死亡した患者の診療を担当したことがあり、最後の接触時(自殺の3か月以内)に低リスクと判断された患者の臨床家20~30名が対象となった
NHSに対する調査の結果
・リスク評価ツールに関して、調査対象となった85カ所の国民保健サービス(NHS)拠点全てから回答がえられ、156のリスク評価ツールが回答された。その中で主に使用されているツールが特定された
・評価ツールの3分の1以上は各地域で考案されたものであった。20%はelectronic patient recordを活用したRio risk screenを用いていた
北アイルランドではすべてのNHSで2段階プロセスを採用しており、最初にすべての患者を対象とした標準化されたリスクスクリーニングツールを使用し、その後に包括的な臨床リスク評価および管理ツールを使用していた。・85個中72個(85%)はチェックリスト形式であり、全てのツールにおいて特定されたリスクをより詳細に説明できるようにテキストボックスで記録するオプションが含まれていた。
・ほとんどのツール(94%)では、患者の将来の行動を予測し、リスクを高、中、低などのように層別化するよう構成されていた。
・患者を積極的にケアに参加させることについては59%のツールにおいて推奨しており、評価されたリスクについて患者の確認を得ることから、患者との協働作業についての詳細まで様々な程度で記載されていた。
・62%のツールでは臨床家が、患者、支援者双方からの意見を聴取することを推奨し、協働作業の詳細について解説していた
オンライン調査の結果
・オンライン調査は358人が対象となり。うちわけは患者42名、支援者26名、臨床スタッフ290名(看護師109名、医師または精神科医34名、管理者48名、心理士22名、作業療法士7名、ソーシャルワーカー8名、その他医療従事者62名)であった
・患者42名中15名はデータ不足のため分析から除外。残りの27名中20名(74%)は、アセスメントの際に支援者や家族が同席する機会を与えられなかったと報告した。9名(33%)は危機時の連絡先に関する情報を提供されていなかった。12名(44%)はアセスメントのプロセスに批判的であった
・批判的な意見では、評価の非人間的な性質が強調されており、自分の感情や意見が無視されているとの意見が述べられていた。ある患者は「調査フォームは政府の調査のように感じる」と述べ、別の患者は「自殺についての質問は評価ではすぐに流されてしまう」と自殺についてのアプローチを批判した。「自殺について真正面から取り組み、もっと詳しく質問する必要があると思う。一度の質問だけでは十分ではない」との意見もあった。
・6人(22%)の患者は、リスクを評価する際のスタッフのアプローチに一貫性がないと感じていた。「決められた手順がなく、その場しのぎのものであり、受診する職員に依存する。スタッフのためのトレーニングをもっと充実させる必要がある」との意見もあった
・26人の支援者の回答のうち20人が分析対象となった。9人(45%)が、安全性について話し合われた際に患者との評価に出席したと報告し、同じく45%が、ミーティング中に自分の意見が認められたと感じていた。
・しかし際立った課題として、支援者が患者の支援計画や安全計画に参加することが不足していることへの不満と失望であり、それは家族では手に負えないとケアチームに解釈されているとの感覚につながっていた。
・ある支援者は、「コミュニケーションは私からケアチームへの一方通行であり、自宅で深刻化する状況をどのように管理すべきかについての議論または情報がなかった」と述べた。
・潜在的なリスクについて意見を述べる機会がないことへの懸念も指摘されている。「安全計画には支援者の意見はほとんど含まれていないのに、自殺願望のある子どもの世話を24時間365日していた。ケアや危機管理計画についてほとんど知らされておらず、うまくいかなかったときにはそれに従うことを期待されていただけで、実際に考えたり、考慮したりすることなく、全体が『チェックボックス』のように見えた」との意見もあっ
・臨床スタッフへの調査結果として、臨床医は、ツールの要約結果について、他の医療チームに問題点を伝えるのに有用なものと回答した。また、評価ツールの使用は、患者との信頼関係を築き、率直な会話を促進し、現在および過去のリスク要因を探ることができる貴重な機会であると捉えていた。
・「リスク評価ツールはリスクとレジリエンス要因について考えるための良い枠組みを提供するが、臨床経験に取って代わるものではない。患者に関する情報は臨床病歴に基づいており、広範な環境要因は含まれていない傾向がある」との意見がみられた
・定期的なトレーニングの重要性を指摘する意見もあった
・課題として評価ツールが長く煩雑な場合、重要な患者の詳細を見落としてしまう可能性があるという懸念が表明された。またツールが長すぎると、関連性の低い分野については記入するのを躊躇してしまうとの意見もあった
・またリスク評価ツールは、それを実行する個人の介入能力を上回るものではなく、誤った安心感を持たないようにということを指摘する意見もあった
電話インタビューの結果
・電話インタビューでは、22名の臨床スタッフが対象となり、精神科医(13名)のほか、看護師、ソーシャルワーカー、心理士(9名)が参加した
・インタビューした臨床スタッフは全員、ツールを予測手段としてではなく、リスクに関しての判断を分類するためのガイドとして使用していると感じていた。
・ある臨床医は、「あなたの仕事は誰が死ぬかを予測することではなく、患者が提示した問題に有益な方法で関与することである」とコメントしている。
・臨床医はツール自体を意思決定の判断役とするのではなく、臨床判断に基づいて治療計画を通知し、策定するためにツールを使用していた。
・リスクサマリや系統的記載は、入院患者と地域ケアの間の移行を容易にするなど、ケアチームに良いコミュニケーション源を提供するものと捉えられていた。
・徹底的な病歴を収集し、その情報を一つの文書にまとめることは、患者との率直な議論を促進するために有用であると考えられた。
・一方で治療関係にはオープンな会話が必要であり、チェックリストが流動的な会話を奪ってしまうため、オープンな会話が妨げられている可能性があるという問題も示された。
リスク評価ツールの改善点についての意見
(1)臨床スタッフ
・スコアリングシステムやレーティングシステムを削除すること
・一貫性の向上と簡潔化
・全ての専門用語を解説し、患者や支援者にとって評価ツールを使いやすいようにすること
・継続的なトレーニングとスーパービジョンを通じてスタッフの自信を高めること
(2)患者
・チェックリストに頼らない個別化されたアプローチをすること
・希死念慮に焦点をあてること。スタッフが自信をもって難しい質問を扱えるよう促すこと
・クライシスプランや安全計画の共有を含め、家族や支援者を巻き込むこと
・地域の支援選択肢やヘルプライン、24時間対応のサービスに関する情報提供
(3)支援者
・危機的状況に陥る前、または危機的状況に陥った時に、家庭での状況管理の方法や、何を想定すべきかについての情報や助言を得ることができること
・患者を支援するための技術と知識を獲得するための訓練が提供されること
・支援者が孤立感を感じないようにすること
・患者の同意がある場合には、家族とのより一貫性のある相談体制と情報共有。リスクの高い行動について家族や支援者と話し合うこと
まとめ(文献4より引用)
(1)リスク評価ツールは、将来の自殺行動を予測する方法と見なすべきではない。これはNICEの自傷行為ガイドラインと一致している。(2)ツールを使用する場合は、シンプルでアクセスしやすく、より広範な評価プロセスの一部として考慮されるべきである。治療方針は点数によって決定されるべきではない。
(3) リスクツールは自殺の予防にはほとんど役に立たないというコンセンサスが広まっている。本研究は、臨床的判断を重視し、関係性を構築し、現在の状況、既往歴、社会的要因に関する情報を収集し、共同で開発した管理計画を充実させることにより、臨床的なリスク評価プロセスを改善する方法を提案するものである
(4)リスク評価のプロセスは精神保健サービス全体で一貫している必要があり、スタッフはリスクの評価、策定、管理の方法について訓練を受けるべきである。
(5) 家族や支援者は、潜在的なリスクについて意見を述べる機会を含め、アセスメントのプロセスに可能な限り多くの 関与を持つべきである。管理計画は、可能であれば共同で作成されるべきである。
(6) リスクの管理は個人的で個別化されたものでなければならないが、同時にシステム全体のアプローチとしてすべての人に対する標準的ケアの質を高めるものであるべきである。監督、委任、紹介経路がすべて安全に管理されていることが保障されるべきである
コメント
・今回の報告の結果を踏まえて日本精神科救急学会のガイドライン(https://www.jaep.jp/gl_2015.html)をみると、家族などへの支援やケアの項目などもきちんと整理されており、素晴らしい内容であることがわかります。
・課題は実践的なトレーニングの充実ということになるでしょうか
引用文献
文献1:Carter G, Milner A, McGill K, Pirkis J, Kapur N, Spittal MJ. Br J Psychiatry. 2017 Jun;210(6):387-395. doi: 10.1192/bjp.bp.116.182717. Epub 2017 Mar 16.
文献2:Lancet Psychiatry. 2020 Dec;7(12):1046-1053. doi: 10.1016/S2215-0366(20)30381-3. Epub 2020 Nov 12.
文献3:J Affect Disord. 2014 Jun;161:36-42. doi: 10.1016/j.jad.2014.02.032. Epub 2014 Mar 12.
文献4:The assessment of clinical risk in mental health services. National Confidential Inquiry into Suicide and Safety in Mental Health (NCISH). Manchester: University of Manchester, 2018. -
ルマテペロン
2020年11月14日
・2019年12月にアメリカで統合失調症治療薬として承認されたルマテペロンの薬理作用と臨床試験の報告をまとめてみます。
・基礎実験の報告だけみるとなんだかすごい薬のように思えますが、実際はどうなのでしょうか?
・特記すべきこととしては、PETで線条体D2受容体占有率が約40%とされているlumateperone tosylate 60mg(ルマテペロンとして42mg)の投与量において、臨床的有効性が報告されていることです。そのためEPSリスクが低いことが期待されます。
・またルラシドンと同様にヒスタミンH1受容体阻害作用およびセロトニン2C受容体阻害作用がほとんどなく、体重増加や過鎮静が起こりにくいことが期待できることもあります。
・薬理学的特徴としては、基礎実験の結果からは、シナプス前ドパミンD2受容体には部分アゴニスト作用を有すること、D1受容体への作用が比較的高いこと、セロトニントランスポーター阻害作用を有していることなどです。
・シナプス前ドパミンD2受容体に対しては部分アゴニスト作用を有するため、多くの抗精神病薬がシナプス前ドパミンD2受容体を阻害し、ドパミン合成なども阻害し、黒質線条体経路における錐体外路症状発現リスクをさらに増加させるのと異なり、ルマテペロンは黒質線条体ドパミン神経におけるドパミン代謝を変化させず、そのため錐体外路症状が起こりにくいことが期待されること。さらにはD1受容体への作用を介して、側坐核のグルタミン酸神経系の神経伝達を高めることが期待でき、統合失調症のグルタミン酸仮説で言われているNMDA受容体の機能低下を補い、治療的に作用しうることが期待できることなどが言われています。
・果たしてそのような結果が臨床試験で見られたのでしょうか?まずは基礎実験からの報告(文献1)を要約してみます。
薬理学的特徴
・Tmax 3~4時間
・主にCYP3A4で代謝
・半減期は13時間で、ルマテペロンと同等の活性を有する活性代謝物の半減期は約20時間。1日1回投与でOK
・セロトニン2A受容体への親和性が強い(Ki=0.54nM。D2受容体(Ki=32nM)、D1受容体(Ki=52nM)への親和性もあり。セロトニントランスポーターへの親和性もドパミン受容体と同等程度に有する
・抗ヒスタミン作用は極めて弱く、セロトニン2C受容体への親和性も低い(Ki=173nM)。体重増加の副作用がほとんどないことが期待される。この点はルラシドンにも似ている
・シナプス前D2自己受容体(刺激によりドパミン合成が促進)に対しては、多くの抗精神病薬と異なり部分アゴニストとして作用し(シナプス前D2受容体活性のマーカーである線条体でのチロシンヒドロキシラーゼのリン酸化などの指標を変化させないことから)、シナプス後D2受容体にはアンタゴニストとして作用(in vitroで用量依存性にGSK3βのリン酸化を増加させる)
・低用量では選択的なセロトニン2A遮断薬として機能し、高用量でドパミン系やセロトニントランスポーターへの作用が顕在化する
・中脳辺縁系および中脳皮質経路に対して選択的な作用を発揮する。齧歯類での実験では、内側前頭皮質でのドパミン放出を増加させ、D1受容体との間接的な相互作用を介して、側坐核におけるNMDA受容体のリン酸化を引き起こし、グルタミン酸系の神経伝達を高めることが期待される(統合失調症のグルタミン酸仮説ではNMDA受容体の機能低下が想定されており、この点でグルタミン酸系の神経伝達を高めうることは治療的に作用する可能性がある)。またドーパミンD2受容体を含む前頭前野および側坐核神経細胞のシグナル伝達物質であるGSK3のリン酸化を増加させることが確認されている。
・一方で線条体におけるドーパミン放出やNR2BとGSK3のリン酸化、線条体におけるドーパミン代謝やチロシン水酸化酵素活性などは増加させず、運動機能障害(齧歯類におけるカタレプシー)についても増加させないことが報告されている
・抗精神病薬は陽性症状への有効性が期待できるが、線条体D2占有率が80%以上に達した場合には錐体外路症状が生じうるとされる。しかしルマテペロンは上記のような経路選択性により、運動機能障害を引き起こすことなく、精神病や幅広い症状に対して効果的な作用を発揮する可能性がある。(コメント:シナプス前ドパミン自己受容体への部分アゴニスト性からこのような選択性が生じうるとされる)
・ルマテペロンは強力なセロトニン2A受容体拮抗作用と、ドパミン受容体下流のリン酸化蛋白質経路の調節作用を有している。ドーパミン受容体リン酸化蛋白質調節剤(DPPM)として、ルマテペロンは中脳辺縁系/中脳皮質経路選択性を有し、シナプス後D2受容体アンタゴニストとシナプス前D2部分アゴニストの2つの特性を併せ持っている。
・また、D1受容体の細胞内シグナル伝達の下流に位置する、中脳辺縁系のグルタミン酸作動性NMDA受容体のリン酸化を促進し、グルタミン酸経路の神経伝達を促進することが期待される。
・そのため理論的には、運動機能障害を呈することなく統合失調症に伴う陽性症状、陰性症状、認知症状に対する有効性が期待される。また、抗精神病薬の中では珍しく、セロトニン再取り込み阻害作用を有しており、抗うつ作用を発揮することも期待されている
PET試験より
・線条体D2受容体占有率は、 lumateperone tosylate 40mg投与時には39%。 lumateperone tosylate 10mgの低用量では、皮質のセロトニン2A受容体占有率がほぼ飽和し(前頭前野では平均88%)、線条体D2受容体占有率は平均12%であった。
・高用量( lumateperone tosylate 40mg)では、線条体のセロトニントランスポーター占有率が31%。40mgまで増量すると、完全に飽和したセロトニン2A受容体系の上にドーパミン受容体とセロトニントランスポーターを含む占有率が増大するが、シナプス後ドパミンD2受容体の占有率は中等度であった
・統合失調症患者に対して有効用量である60mgのlumateperone tosylateを1日1回経口投与して2週間後の線条体D2受容体占有率は平均40%であり、他の抗精神病薬が有効性を達成するために必要とする線条体D2受容体占有率の範囲よりも低かった。
ルマテペロンの第3相試験(文献3)
対象と方法
・対象:18-60歳の統合失調症患者(DSM-5)、BPRS40点以上(陽性症状尺度2つ以上で4点以上)の精神病症状急性増悪患者。最近4週間以内で急性増悪したもの、CGI-Sで4点以上、PANSS totalで70点以上、これまでに抗精神病薬治療への治療反応歴があること
・プラセボ対照無作為割付比較試験
・試験期間:4週間
・lumateperone tosylate 60mg(ルマテペロン42mg相当) N=150
・lumateperone tosylate 40mg(ルマテペロン28mg相当)N=150
・プラセボ N=150・主要評価項目はPANSS totalスコアの平均変化量
・副次評価項目はCGI-S、PANSS positive,negative,general、Calgary Depression Scale for Schizophrenia(CDSS)など
結果・完遂率は42mg群 85.3%、28mg群80%、プラセボ群 74%
・42mg群はPANSS totalにおいて4週後にプラセボ群より有意に改善(プラセボ群とのLeast-squares mean differenceは-4.2点 )。28mg群は有意差なし
・PANSS totalで30%以上の改善を反応とすると42mg群 36.5%、28mg群 36.3%、プラセボ群 25.5%
・PANSS postiveは42mg群、28mg群ともにプラセボ群より有意に改善
・PANSS negativeは有意差なし
・PANSS generalは42mg群で有意差あり
・CDSSは有意差なし
・有害事象については42mg群の64.7%、28mg群の56.7%、プラセボ群の50.3%に出現
・プラセボ群の2倍以上もしくは5%以上でみられた副作用は、傾眠(42mg群 17.3%、28mg群 11.3%)、鎮静(42mg群 12.7%、28mg群 9.3%)、疲労感(42mg群 5.3%、28mg群 4.7%)、便秘(42mg群 6.7%、28mg群 4.0%)
・錐体外路症状はいずれの群も5%未満
・体重増加は42mg群 0.9kg、28mg群 0.6kg,プラセボ群 0.7kgで有意差なし
コメント
・やはりこの第3相試験でもプラセボ群がベースラインから10点くらい改善しています。ここ最近の臨床試験ではだいたいその傾向(ブレクスピプラゾール、ブロナンセリンパッチ、ルラシドンなど)があり、unblinding biasがないためかもしれません(安全性が高い薬剤の場合、評価者に副作用によりプラセボとの違いがなんとなくわかってしまうこととがないため、そうでないために生じるunbliding biasが混入しない:文献3)
・抗H1作用がほとんどないのに傾眠が有意に多かったのは何故でしょうか。どのような説明ができるのかわかりません。
・またセロトニントランスポーター阻害作用を有するもののCDSSは有意差がありませんでした。いろいろな作用部位がある薬剤において理屈では期待される作用がみられない(例えばボルチオキセチンの抗不安作用が期待されるほどないなど)のはよくあることで、そう簡単にはいかないということなのだと思います。
・体重増加は期待通り有意なものはありませんでした。また確かに錐体外路症状は少なく、安全性はかなり期待ができそうです。その点文献1にもありますが、高齢者やBPSDに対する処方としても適応となりうるかもしれません。
引用文献
文献1:Davis RE, Correll CU. ITI-007 in the treatment of schizophrenia: from novel pharmacology to clinical
outcomes. Expert Rev Neurother. 2016;16(6):601-614.doi:10.1080/14737175.2016.1174577
文献2:Correll CU, et al. JAMA Psychiatry. 2020. PMID: 31913424
文献3:Holper L, Hengartner MP.BMC Psychiatry. 2020 Sep 7;20(1):437. doi: 10.1186/s12888-020-02839-y.




