-
今年も1年ありがとうございました
2021年12月31日
・コロナで始まりコロナで終わる1年となりますが、皆様におかれましては穏やかな年の瀬をお迎えでしょうか。
・この1年病院としても感染対策のため様々な制約があるなか、関係者の皆様のご理解、ご協力をいただき、職員一同地域の精神医療の維持のため、業務を継続できましたこと、心より感謝申し上げます。
・勉強会については今年も引き続きリモートでの開催となりました。足掛け2年で精神医学の主要分野を網羅した形になりますが(ここでご紹介した内容はごく一部で、実際には関連分野の日本語の文献や専門医試験などをメインにした勉強会になっています)、新年度からは新たなメンバーも迎え、がんばっていきたいと考えています。
・また、当院は初期臨床研修の協力施設にもなっており、今年度も複数の初期研修の先生を大田市立病院からお迎えしました。多くの先生は1カ月間の研修期間ですが、年明けから数カ月間研修する先生がおられ精神科志望らしいので、濱田秀伯先生の「精神病理学臨床講義」や「精神症候学」、松本卓也先生の「症例でわかる精神病理学」などを輪読してみてもいいかなと考えています。
・来年も引き続き、地域医療の維持発展のため尽力していく所存ですので、皆様からのご指導ご鞭撻のほど何卒宜しくお願いいたします。
・来年が皆様にとって幸多き一年であります事を祈念いたします。
令和3年12月31日
石東病院
院長 安田 英彰 -
アゴメラチン
2021年12月24日
・アゴメラチンといえは、こちらの論文(Luo Y. et al. Res Synth Methods. 2021 Jan;12(1):74-85.)で高い受容性を示しており、なんとなく気になっていたのですが、今回児童思春期うつ病に対する介入試験が報告されました。
・アゴメラチンはメラトニン受容体刺激作用とセロトニン2C受容体拮抗作用を併せ持つユニークな物質で構造式としては結構メラトニンに似ているようです。
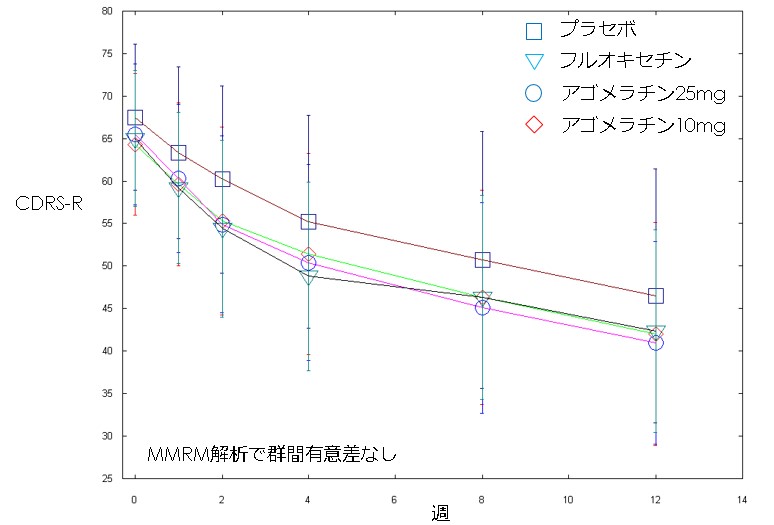
・今回、アゴメラチンの児童思春期うつ病に対する介入試験が公表された(文献1)ので、見てみます。ただ、併用した心理療法についての詳細がサプリメントにも簡単にしか記載されていなくてよくわからなかったり、図が全くない(これについては、主な解析手法の性質上仕方ないのかもしれないですが)など、なんだか物足りない感じもしました。結果を図示してみたかったので、最後にサプリメントの生データを使用して図を勝手に作ってみてます。
心理療法併用児童思春期うつ病へのアゴメラチン
背景
・現在児童思春期うつ病(8-17歳)に対してFDAおよび欧州医薬品庁から承認されている薬剤はフルオキセチンのみ、思春期うつ病(12-17歳)に対してはさらにエスシタロプラムがFDAから承認されている。・アゴメラチンは、メラトニン受容体アゴニストおよび5-HT2C受容体アンタゴニストというユニークな作用機序を持ち、成人うつ病に承認されている
・今回児童思春期うつ病患者を対象に、心理療法併用で、プラセボおよびフルオキセチン対照で介入試験を行った
対象と方法・7-11歳(児童)および12-17歳(思春期)の大うつ病患者で、3週間のrun-in期間における心理療法に反応しない(CDRS-Rで45点以上)もの
・治療抵抗性うつ、精神病性うつ、入院症例、自殺企図リスクのある患者などは除外
・プラセボ対照無作為割付二重盲検比較試験
・心理療法は月1回のセッション+宿題で行われ、1回のセッションは45分。(1)心理教育、(2)気分・思考の観察、(3)資源の強化、(4)問題解決スキル、(5)家族間交流などから構成された。
・試験期間:12週間
・アゴメラチン10mg群 n=102
・アゴメラチン25mg群 n=95
・フルオキセチン10-20mg群 n=100
・プラセボ群 n=103・主要評価項目:12週間のCDRS-Rの変化量
結果
・中断率はアゴメラチン10mg群 8%(102例中8例)、アゴメラチン25mg群 12%(95例中11例)、プラセボ群 16%(103例中16例)、フルオキセチン群 13%(100例中13例)・罹病期間の中央値は94.5日
・独立変数として治療群、国、年齢サブグループ(児童および思春期)の3つの固定要因、共変量としてベースラインの特性(詳細不明だがおそらく性別や罹病期間、過去のエピソード回数など?)を用い、12週時点でのCDRS-Rのベースラインからの変化量を三元配置共分散分析で評価した結果、調整後のCDRS-Rの変化量のプラセボとの差は、アゴメラチン10mg群 3.18(95%CI -0.37 to 6.73)、アゴメラチン25mg群 4.22(95%CI 0.63 to 7.82)、フルオキセチン群 3.74(95%CI 0.18 to 7.30)であり、アゴメラチン25mg群とフルオキセチン群はプラセボと有意差あり。
・効果量はアゴメラチン25mg群で0.29、フルオキセチン群で0.26
・12週時点でのCDRS-R28点以下で定義した寛解率は、アゴメラチン10mg群、102例中14例(14%)、アゴメラチン25mg群、94例中15例(16%)、フルオキセチン群99例中12例(12%)、プラセボ群101例中11例(11%)で有意差なし
・12週時点での反応率(CGI-Iで1点ないし2点で定義)はアゴメラチン10mg群48%、アゴメラチン25mg群49%、フルオキセチン群47%、プラセボ群45%で有意差なし
CGI-Sも有意差なし議論
・過去に行われた小児臨床試験におけるフルオキセチンの効果量(0.4~0.5)よりやや低い数値となった。プラセボ反応率が高かった。
コメント
・アゴメラチンの利益という観点からはごくわずかという印象です。効果があるとしてそれがコストに見合うのか、というところになりそうです。プラセボ反応率が高いのは心理療法の効果が大きかったのでしょうか。しかし心理療法は月に1回、12週間で3回のみなので、そこまで大きな効果があったのか疑問です。最後にCDRS-Rの変化の様子を図示しておきます。
文献1:Celso Arango et al. Lancet Psychiatry. 2021 Dec 14;S2215-0366(21)00390-4. doi: 10.1016/S2215-0366(21)00390-4. Online ahead of print.
-
ベンゾジアゼピンと認知症
2021年12月17日
・スタチンの認知症予防効果(5年程度までの使用で)について観察研究から得られた結論(Lancet. 2000 Nov 11;356(9242):1627-31.)が介入試験で覆った(Lancet. 2002 Jul 6;360(9326):7-22)ように、観察研究から得られるメッセージというのは、交絡因子の影響などの危険性から慎重にとらえる必要があります。
・観察研究から得られる暴露とアウトカムの因果関係はBradford hill基準で評価され、ベンゾジアゼピンと認知症との関係については文献(Drugs R D. 2017 Dec;17(4):493-507)で示された通りで、それ以上でもそれ以下でもなく、特に観察研究間のinconsistencyがあり、はっきりしたことはいえないという現状ですが、ちょっと目を引く論文(文献1)が出たので、一連の流れをまとめておきます。といっても、この論文も横断研究なので、エビデンスの質という点では乏しいものです。
・そもそもベンゾジアゼピンと認知症との関係については、認知症のリスクになるという報告と、一方で保護的であるかもしれないとの報告(Alzheimer Dis Assoc Disord 1998;12:14-7.など)が1990年代からあり、長らく議論されてきました。
・長期暴露との関連性については、やはり観察研究に頼らざるをえないため、大規模な前向きコホート研究での検証が必要でした。
・前向き研究でまず注目すべき報告は2012年のBMJ論文(文献2)かと思います。
・この研究では1987年から1989年までの間にフランスのGirondeおよびDordogne地方在住の65歳以上の住民からランダムで3777人を抽出し、2-3年ごとにフォローアップを実施し、最大20年間追跡されました。評価時には生活習慣や社会的背景、性格特性、健康状態、薬剤使用、社会的機能、うつ症状、認知機能などが対面評価されました。
・さらに、逆の因果関係(認知症の前駆症状としての不安や不眠に対してベンゾが投与される可能性)の問題にも配慮するため、エントリー後、3-5年間の観察期間を設け、最初3年間でベンゾジアゼピン使用がなく認知機能低下もなく、かつ5年目の試験開始時に認知症ではない群(3年目から5年目の間にベンゾを新規投与され5年目時点で投与されていた群が投与群、投与されていない群が非投与群とされた)がエントリーされました。(3年目と5年目の時点で認知機能の低下がないことから、認知症の前駆症状としてベンゾが投与されたわけではないことの根拠にしたということでしょうか。しかしこの方法で逆因果関係を完全に除去することは困難に思えます。前駆症状としての不安や不眠があるとして、どのくらいの期間で認知症になるのかのデータは知らないのですが、ベンゾを開始してから一定期間後も認知機能の低下がない群をエントリーすべきような気もします。このようなことを気にしないためにもやはり介入試験がほしいところです)
・5年目時点で認知症がなく、かつ3年目時点までベンゾジアゼピンの使用歴がない1063人が対象となり、対象者1063名のうち、95名(8.9%)が試験開始時(5年目時点)にベンゾジアゼピン暴露群とされました
・15年間の追跡調査(中央値6.2年)において、ベンゾジアゼピン使用者で30名(32%)、非使用者で223名(23.0%)の認知症が発生しました。認知症発症までの期間はベンゾジアゼピン使用者で有意に短く、ベンゾジアゼピン使用は認知症のリスクの有意な上昇(ハザード比 1.60, 95%CI 1.08~2.38 )と関連していました。さらに抑うつ症状で調整しても、この結果は変わりませんでした(ハザード比1.62、1.08~2.43)。
・この報告の欠点は、ベンゾジアゼピンの累積暴露量と発症リスクとの関連性が明らかではないことです。この点を明らかにすべく、2014年に同じグループが、カナダのケベック州のデータベースを基に後ろ向きの症例対照研究を報告しました(文献3)
・この報告では、2000年1月1日から2009年12月31日まで、ケベック州に暮らす高齢者(66歳以上)で、public drug planに加入していた人(ほぼ全員)が対象となりました。RAMQデータベースに記録された処方箋と医療サービスから情報が抽出されました。調査期間中にアルツハイマー病(ICD-9)の初診日があり、その日以前に他のタイプの認知症の記録がない、初診日以前に抗認知症治療を受けていない、初診日以前に少なくとも6年間の調査期間があることなどがエントリー条件となりました。発生密度サンプリングにより症例にマッチする4名の対照者が抽出されました。
・投与されたベンゾジアゼピンの累積処方量を平均1日用量で割り、PDDs(prescribed daily doses)に変換され、1~90 PDDs(累積暴露量3 ヶ月以下の群)、91-180 PDDs(累積暴露量3-6ヶ月の群)、 180 PDDs以上(累積暴露量6ヶ月以上(長期使用者)の群)に分類されました
・多変量条件付きロジスティック回帰分析の結果、3ヶ月までの累積暴露量、すなわち1~90PDDsではベンゾ暴露群と非暴露群とで認知症リスクは有意差なし(OR 1.09、95%CI 0.92~1.28)でした。一方3ヶ月から6ヶ月までの累積暴露群(91-180 PDDs)では調整後オッズ比 1.32(95%CI 1.01~1.74)、6ヶ月以上の累積暴露群(180PDDs以上)では調整後オッズ比 1.84(95%CI 1.62~2.08)と認知症リスクの有意な上昇を認めました。
・このようにベンゾジアゼピンへの累積暴露量が多いほど、認知症リスクが上昇することを示唆する結果となりました。
・文献3は後ろ向き研究でしたが、今度はベンゾジアゼピンへの累積暴露量と認知症との関連を前向きに検討した論文が2016年に公表されました(文献4)
・この研究では、認知症のない65歳以上の参加者が、シアトル地域のグループ・ヘルス会員から無作為に抽出されました。1994-96年に2581人が登録、2000-03年に811人が追加登録されました。
・参加者は、研究開始時とその後2年毎に、認知機能、年齢、性別、胸苦年数、病歴、健康行動、健康状態を評価されました。また研究開始時および2年ごとの訪問時に、認知機能スクリーニング尺度(CASI)を用いて認知症のスクリーニングが行われ、スコアが85以下の参加者は、身体検査、神経学的検査、神経心理学的検査を含む標準化された認知症の診断評価を受けました。
・追跡期間は10年間で、使用薬剤は、グループ・ヘルスの薬剤データベースから確認されました。
・累積暴露量の計算のため、各処方箋の薬剤用量と調剤錠数を掛け合わせたベンゾジアゼピン系薬剤の総投与量が算出され、さらに、高齢者に推奨される1日あたりの最小有効量で割って、標準化1日投与量(SDD)が算出されました。各参加者について、10年間の暴露期間中に処方されたすべてのベンゾジアゼピン系薬剤のSDDを合計し、標準化一日投与量の累積値(TSDD)が算出されました。参加者は、10年間の累積暴露量を使用なし群、1-30 TSDD群、31-120 TSDD群、121 TSDD以上の群に分類されました(連続使用か、間欠的な使用かは区別せず)
・3434人が解析対象となり、平均7.3年追跡されました。この間、797人(23.2%)が認知症を発症し、うち637人(79.9%)がアルツハイマー病でした。
・多変量Cox比例ハザードモデルで解析の結果、累積暴露量が最高用量(121 TSDDs以上)群では、認知症(調整後ハザード比1.07、95%CI 0.83~1.37)およびアルツハイマー病(調整後HR 0.95、95%CI 0.71~1.27)は、非使用群と比較して、調整後ハザード比において有意なリスク増加はみられませんでした。
・ベンゾ非使用群と比較して、低暴露群(1-30 TSDDs、調整後HR=1.25、95%CI 1.03~1.51)または中暴露群(31~120 TSDDs、調整後HR 1.31、95% CI 1.00~1.71)では認知症のリスクがわずかに増加しましたが、アルツハイマー病のリスク増加は低暴露群のみで認められました(調整後HR 1.27、95%CI 1.03~1.57)。
・以上の通り前向き研究では2014年のBMJの報告(文献3)と異なる結果(高用量暴露ではアルツハイマー病のリスク増加は有意ではなく、低用量暴露では有意に増加)となりましたが、その理由として、文献3では、アルツハイマー病の症例の特定のために行政データベースを利用しており、ベンゾジアゼピンを多用する人は、医療システムとの接触頻度が高く、その結果、認知症が認識されコード化される可能性が高くなったためかもしれないなどと考察されています。
・その後2020年に文献5のデンマークでの前向きコホート研究が報告されました。この内容は2020年4月14日付の当ブログで記事にした通りです。結果の概略は、nested case-control研究での解析結果では、最も通算用量の少ないベンゾジアゼピンを処方された群は、全く処方されたことのない群と比較して、わずかな認知症リスクの上昇がみられ(オッズ比 1.08)、一方で最も通算用量の多い処方を受けた群は有意に認知症発症リスクが低い(オッズ比 0.83)結果となりました。
・この結果がなんでこんなことになったのか、混乱していましたが、文献1では、横断研究ながら、MCIの症例を対象に、PETにてベンゾジアゼピン暴露により、非暴露群と比較して、皮質におけるアミロイド沈着(を小脳および橋におけるアミロイド沈着で割って標準化した数値)が有意に少ない結果(cohen's d=0.43)となったことが報告されました。
・もしかしたら、保護的作用があるのかもしれませんが、確定的なことは言えず、この先、さらに前向き試験で検討されるべき課題と思われます。さらに文献1にも記載されている通り、ベンゾの慢性的な使用は、転倒のリスク増加、依存性、認知障害(少なくとも服用中は主に注意力、記憶、遂行機能の障害)など、有益性を確実に上回る有害事象がありますし、2020年12月15日に当ブログで記事にしたとおり、ベンゾの長期使用を中断することによるメリットも存在しうるので、ベンゾの慢性投与は全く推奨されないことになります。
文献1:Quentin G. et al. Neuropsychopharmacology. 2021 Dec 10. doi: 10.1038/s41386-021-01246-5
文献2:Billioti de Gage S, et al. BMJ. 2012 Sep 27;345:e6231. doi: 10.1136/bmj.e6231.
文献3:Billioti de Gage S, et al. BMJ. 2014 Sep 9;349:g5205. doi: 10.1136/bmj.g5205.
文献4:Gray SL, et al. BMJ. 2016. Feb 2;352:i90. doi: 10.1136/bmj.i90.
文献5:Osler M et al. Am J Psychiatry. 2020 Apr 7:appiajp201919030315 -
ピマバンセリン
2021年12月09日
・ピマバンセリンと言えば、セロトニン2A受容体の逆作動薬であり、パーキンソン病に伴う幻覚妄想症状に対してFDAの承認を得ていることで知られていますが、今年7月にはNEJM誌に認知症全般における精神病症状について、再燃予防効果を検証するプラセボ対照試験が報告されました(N Engl J Med. 2021 Jul 22;385(4):309-319)
・この報告では、オープン試験期間中にピマバンセリンの有効性がみられた(投与開始8週時点および12週時点でSAPS-H+D総得点でベースラインと比較して30%以上の改善+CGI-Iで1点か2点を満たすもの)ケースについて、プラセボに置換した場合と継続投与された場合との二重盲検無作為割付比較試験が行われました。その結果、再発率は26週間で、ピマバンセリン群で13%、プラセボ群で28%(再発までの期間のハザード比、0.35;95% CI 0.17~0.73;P=0.005)となり、再発リスクを65%低下させたというものでした。ただし認知症のサブタイプについて解析すると、その有効性についてプラセボとの有意差がみられたのはパーキンソン病認知症のみであり、アルツハイマー型認知症に限って解析すると、再発リスクについてプラセボとの有意差はみられなかったというものでした。
・今回は、統合失調症のpredominant negative symptomに対するピマバンセリン上乗せの有効性に関するプラセボ対照試験が報告されました(Bugarski-Kirola D et al. Lancet Psychiatry. 2021 Nov 30:S2215-0366(21)00386-2. doi: 10.1016/S2215-0366(21)00386-2. Online ahead of print. )。
・predominant negative symptomは主として慢性期における一次性陰性症状が主体で陽性症状が目立たない状態のことでprominent negative symptomは陰性症状を強く認めるものの、陽性症状も混在する状態として定義されているようです。ここで一次性陰性症状と二次性陰性症状とは、以下の図で示す通りの概念となります(竹内 啓善 臨床精神薬理 12:2083-2102、2009より引用)
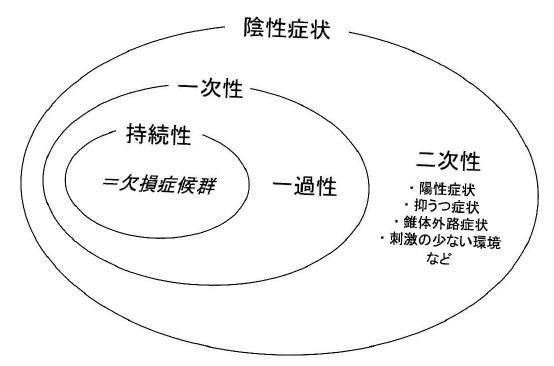
・一次性陰性症状の中核に位置する欠損症候群の診断基準には、感情の狭小化、情動変化の減少、会話の貧困化、興味の減少、目的意識の低下、社会性の低下の6つの項目が含まれており、その診断の詳細については上記竹内先生の文献を参照ください。二次性陰性症状には抑うつなども含まれるため、いかに純粋に一次性陰性症状を抽出するかがポイントになります。そのためにSANSなどの評価尺度が用いられているのですが、今回のBugarskiらの報告ではNSA-16という尺度が用いられました。ちなみに陰性症状にはPANSS negativeもありますが、PANSS negativeは一次性陰性症状の評価には不適切といわれており、その理由としてPANSS negativeに含まれる抽象的思考の困難や常同的思考については、陽性症状主体であっても得点が高くなりうることがあげられます。そのため例えばpredominant negative symptomに関して、カリプラジンがリスペリドンよりも優れていることを示した2017年のLancet論文(Nemeth G et al. Lancet. 2017 Mar 18;389(10074):1103-1113)では主要評価項目にPANSS-factor score for negative symptom(PANSS FSNS:N1、N2、N3、N4、N6、G7、G16の合計点)が使用されています。
・今回の報告で用いられたNSA-16 については並木らの解説(並木千尋ら 精神医学 58:469-480. 2016 )があり、引用させていただくと、下図のような項目から構成されている評価尺度となります。

Predominant negative symptomに対するピマバンセリン
背景
・統合失調症の陰性症状や認知機能障害は、統合失調症の疾病負荷の大きさを陽性症状よりもよく予測しうるといわれている。しかしその治療法はない・D2遮断は健常者でも陰性症状類似の症状を惹起するといわれている。一方でセロトニン2A遮断はNMDA受容体アンタゴニストに起因する症状を緩和し、線条体と大脳新皮質のドパミン放出を増加させるといわれており、陰性症状にも効果があるのではないかといわれている。
・いくつかの非定型抗精神病薬はおそらくはセロトニン2受容体への親和性がD2受容体への親和性を上回るために、二次性陰性症状に対する効果があるといわれている。しかし一次性陰性症状に対する非定型抗精神病薬の有効性はよくわかっていない
・例えば、アミスルプリドとジプラシドンは陰性症状を改善することが報告されているが、これは二次性陰性症状の改善に起因するものかもしれない
・カリプラジンはリスペリドンに対して陰性症状主体の統合失調症患者において有意に良好な結果を示したが、プラセボが含まれていない問題があり、さらに検証を要する。
・2018年のメタ解析では抗うつ薬増強が陰性症状に有効である可能性が示された(第1世代への増強の場合のみ)が、すべての試験でベースラインのうつ症状の重症度が評価されたわけではないため、うつ症状に対する効果が交絡し、二次性陰性症状に対する効果をみている可能性がある
・これまでにセロトニン2Aアンタゴニストや逆作動薬であるM100907、volinanserin、eplivanserinなどで、陰性症状に対する効果についての予備的な結果が報告されている
・選択的セロトニン2A/2C受容体拮抗薬であるリタンセリンは、プラセボ対照試験で陰性症状に対する有効性を示唆する結果が報告されている。
・ピマバンセリンはセロトニン2A受容体逆作動薬であり、そのほかの受容体への親和性がほとんどない。FDAはパーキンソン病の幻覚妄想に対してピマバンセリンを承認している
・第2世代抗精神病薬治療により安定している陰性症状主体の統合失調症患者に、ピマバンセリンを上乗せすることにより、大脳新皮質のドパミン放出が増加し、陰性症状に対して効果が期待できるのではないかとの仮説のもとで、プラセボ対照試験を実施した
対象と方法
・18-55歳の外来統合失調症患者(DSM-5)。SCID-CTで確認されたもの。平均罹病期間11.8年
・罹病期間1年以上で、最近12週間以上安定しているもの
・PANSS Marder negative factor itemsで20点以上(7項目中3項目以上で4点以上もしくは7項目中2項目以上で5点以上)かつPANSS Mader positive factor items8項目の合計が22点以下(4点が2項目以下である、かつ5点以上がないこと)
・CGI-SCH-S(Clincal Global Impression of Schizophrenia Scale-Severity)の陰性症状尺度が4点以上(中等症以上)。CDSS9点以上のうつ症状を有する者は除外。
・十分量のアリピプラゾール、アリピプラゾールLAI、アセナピン、ブレクスピプラゾール、カリプラジン、ルラシドン、オランザピン、リスペリドン、リスペリドンLAIによる8週間以上の治療を受けており、血中濃度で確認された治療アドヒアランスが良好であること。定型薬は不可
・試験期間:スクリーニング4週間、盲検期間26週間、フォローアップ4週間
・非定型抗精神病薬+ピマバンセリン 10から34mg n=201 (10mg 3%、20mg 45%、34mg 54%)
・非定型抗精神病薬+プラセボ n=202
・主要評価項目:26週間のNSA-16の変化量
・副次評価項目:Personal and Social Performance scale (PSP)、 PANSS total、CGI-SCH-I(1点ないし2点を反応群と定義)、BACS、DAI-10など
結果
・併用薬剤はアリピプラゾールないしアリピプラゾールLAIが約33%、リスペリドンないしリスペリドンLAIが約39%、オランザピンが約28%、ルラシドンが1%
・26週間でのNSA-16得点の変化量はピマバンセリン群で有意に良好(最小二乗平均差 -1.9点。Cohen’s d=0.211)
・副次評価項目では有意差なし(NSA-16の20%以上改善の反応率 53%対49%、CGI-SCH-I反応率 32%対29%、PSP得点の変化量有意差なしなど)
・多い有害事象は頭痛(プラセボ群5%、ピマバンセリン群 6%)、傾眠(プラセボ群 5%、ピマバンセリン群 5%)。副作用による中断率はプラセボ群3%、ピマバンセリン群 5%
議論
・事後解析では34mg投与群はより低用量投与群より陰性症状改善度が良好であることを示唆する結果がえられており、全体の54%しか34mgを投与されなかったことを考慮すると、高用量ではさらに良好な結果がえられた可能性はある。しかしPETでの試験ではピマバンセリン20mgでセロトニン2A受容体はほぼ完全に占有されることから、34mgでの効果は、さらに別のセロトニン2Cなどの影響が寄与しているかもしれない。
コメント
・効果量は小さく、有意差がでたとはいえ、それほど大きな臨床的有効性は期待できない結果となりました。ただし、併用した薬剤毎の解析結果はどうなのでしょうか。アリピプラゾールはセロトニン2A遮断は強くないですし、ピマバンセリン併用でより高い効果が期待できそうな気もします。またリスペリドン群ではリスペリドンの用量が気になるところです。ピマバンセリンはリスペリドンよりもセロトニン2A受容体に対する親和性が高いとはいえ、同じセロトニン2A逆作動薬であるリスペリドンの併用下では、ピマバンセリンの作用は目立たなくなるのではないかと思われるためです(それでもリスペリドン2mgへの併用では効果がみられたとの報告もありますが:Herbert Y. Meltzer et al. Schizophrenia Research 141 (2012) 144–152)




