逆説的反応について
2021年05月10日
・本来予想されるはずの作用の逆の反応が生じる逆説的反応(paradoxical reaction)ですが、精神科の臨床場面でも注意すべき以下の3つについて簡単にまとめておきます
(1)オピオイド誘発性痛覚過敏
(2)薬物乱用頭痛
(3)ベンゾジアゼピン奇異反応
(1)オピオイド誘発性痛覚過敏
・これについては被引用数の多い総説を探してみたのですが、ちょっと古い2011年の総説(Pain Physician 2011; 14:145-161)しか見当たらず、最近のいくつかの文献も組み合わせてまとめてみました。
背景
・非癌性疼痛に対するオピオイドの使用が増えており、そのために多くの問題が生じている。
・オピオイドの長期的有効性についてはエビデンスがなく、乱用やオピオイド誘発性痛覚過敏などの副作用の問題がある
・慢性的なオピオイド使用は、逆説的に急性疼痛を誘発したり、疼痛への感作をもたらしたりする可能性があり、オピオイド誘発性痛覚過敏と呼ばれている
・鑑別となるのはオピオイド耐性、オピオイド離脱であり(Singapore Med J 2012; 53(5): 357-360)、その発現機序には共通点があることが推測される。オピオイド誘発性痛覚過敏と耐性については、慢性オピオイド使用に伴い、疼痛が増悪する点で共通しているが、オピオイド誘発性痛覚過敏においては、痛覚感受性が変化しており、オピオイド増量の際にさらに疼痛が増悪する点において、耐性と異なる(耐性では疼痛は緩和する)。
・離脱においては痛覚過敏とアロディニアが特徴であり、オピオイド誘発性痛覚過敏と離脱は共にオピオイド使用に対する痛覚感受性の不均衡によるものである。ただし離脱はオピオイドの急激な減量により引き起こされるのに対して、オピオイド誘発性痛覚過敏では、オピオイドの用量は維持されているか増量された結果として起こりうる
・オピオイド誘発性痛覚過敏の疫学的情報は乏しい。
・症例対照研究において、メサドンを一定用量で慢性投与されている患者において、、オピオイド依存の既往のある患者や健常対照と比較して、寒冷昇圧試験における痛覚閾値の低下が報告されている(J Pain. 2003 Nov;4(9):511-9. )。
・一方で、電気的にあるいは機械的に誘発された疼痛については、オピオイド追加投与時の疼痛閾値において、オピオイド慢性投与のない対照群との差異を検出できなかったとの報告(Pharmacopsychiatry. 1996 Sep;29(5):176-9)があり、痛覚過敏は痛覚の種類による可能性がある。しかし明確な結論はでていない
・6例の慢性疼痛患者における前向き観察研究において、中等量のモルヒネ投与を開始後4週間以内に、寒冷昇圧試験における痛覚過敏が出現したことが報告されている(J Pain 2006; 7:43-8.)
・ほとんどのオピオイド誘発性痛覚過敏の報告がモルヒネなどの強オピオイド使用によるものであるが、比較的力価の弱い、トラマドールにおいても、痛覚過敏の2例報告がある(Pain Physician 2013; 16:41-44)。1例は1年間の慢性疼痛歴がある患者で、トラマドール400mg投与中で、疼痛が緩和しないためフェンタニルパッチなども追加投与されたが、鎮痛薬投与2時間後に疼痛がピークとなるためオピオイド誘発性痛覚過敏を疑われた症例である。もう1例は4年間トラマドール300mgなどを投与されていた慢性疼痛の患者で、トラマドール投与後に疼痛が増悪することと、トラマドールを増量するも疼痛が改善しないことなどからオピオイド誘発性痛覚過敏と診断されたケースである。いずれの症例もトラマドールを中止し、ミダゾラム2mg静注投与と、ケタミン2週間投与により疼痛が改善している。
発現機序
・痛覚受容経路の補償的なアップレギュレーションなどによるものが考えられている
・複数の発現機序が提唱されているが、はっきりしたことはよくわかっていない
(1)中枢グルタミン酸神経系
・最も多く関与の可能性が報告されている発現機序であり、NMDA受容体の関与が考えられている。
・オピオイド誘発性痛覚過敏の発症には、NMDA受容体の活性化が関与しており、NMDA受容体遮断により耐性とオピオイド誘発性痛覚過敏の発症を防ぐことができる。
・カルシウムで制御される細胞内プロテインキナーゼCが、耐性とオピオイド誘発性痛覚過敏の細胞メカニズムに関係している可能性が高い
・モルヒネの長期投与は、脊髄後角においてNMDA受容体を介したアポトーシスにより神経毒性をもたらす
・モルヒネの繰り返し投与により、後根神経節内の侵害受容性ペプチドであるカルシトニン遺伝子関連ペプチドやサブスタンスP濃度上昇が報告されている
・吻側延髄腹内側部(RVM)から生じる下行性疼痛促進経路の活性化によって生じるという仮説もある
(2)脊髄ダイノルフィン
・脊髄ダイノルフィン濃度はオピオイドμ受容体アゴニストの持続注入により上昇することが示されており、これにより一次求心性神経からのCGRPなどの脊髄興奮性神経ペプチドの放出につながると考えられている。末梢の侵害受容器刺激による興奮性神経ペプチドの増加が、侵害受容経路の亢進につながると考えられる
・吻側延髄腹内側部において、興奮性ペプチドの神経伝達物質であるコレシストキニン(CCK)の活性が高まると、脊髄ダイノルフィンを発現亢進する経路が活性化され、その結果、脊髄レベルでの侵害受容性入力が増強される
(3)下行性経路の促通
・オピオイド誘発性痛覚過敏に共通する機序として、吻側延髄腹内側部からの下行性促通経路の活性化があげられる
・吻側延髄腹内側部の神経細胞はオピオイドに対して特異的な反応を示し、下行経路を傷害すると、神経興奮性ペプチドの増加が抑制される
(4)遺伝的影響
・COMT遺伝子多型などが中枢性の疼痛調節機構や、オピオイド誘発性痛覚過敏発症に影響する可能性が報告されている
(5)侵害受容感受性の亢進
・オピオイド誘発性痛覚過敏の病態機序として、一次求心性線維からの神経伝達物質の再取り込み減少は、サブスタンスPやグルタミン酸などの侵害受容性神経伝達物質に対する脊髄神経の反応性亢進と共に、共通のメカニズムと考えられている。
・β2アドレナリン受容体の発現亢進が、オピオイド慢性投与中の変化として観察されている。またモルヒネ慢性投与による、中枢神経系におけるβ2アドレナリン受容体経路を介したシグナル伝達経路の機能的亢進も報告されている。
・いくつかの脳内ネットワークが疼痛の強力な調節因子として働き、特に前頭前野が痛覚知覚の抑制に関与していることが示されている。
・これらの機序に共通する経路として、中枢のカテコールアミン系によって部分的に調節される下行性疼痛抑制系の関与が考えられている。
・これらの経路の機能は、カテコールアミン分解酵素(COMT)活性によって遺伝的に影響を受ける。さらに、内因性オピオイド濃度の低下によるμオピオイド系の活性化能力の低下は、内因性疼痛抑制が効果的に機能せず、より顕著な疼痛感受性の亢進につながる可能性がある。しかし、実験的には、内因性オピオイド系はオピオイド誘発性痛覚過敏に有意な影響を与えないとの報告もある。
(6)その他の機序
・慢性疼痛におけるオピオイド使用が、肥満細胞の持続的活性化による侵害受容器の感作を引き起こし、さらにミクログリアの活性化と脊髄感覚神経の感作につながるとの考えがある。これら炎症促進性経路と痛覚感受性の亢進がオピオイド誘発性痛覚過敏の病態に関与しているとの仮説がある
・肥満細胞の脱顆粒は侵害受容器を活性化する物質を放出し、神経障害性疼痛の原因となる。活性化した肥満細胞は、好中球やマクロファージ動員を促進する。同時に上行性疼痛伝達経路を活性化し、おそらくは痛覚受容体へのヒスタミンの感作作用を介し触覚性痛覚過敏を誘発する。
・さらに神経栄養因子の放出により、TrKA受容体を介した侵害受容器の感作にもつながる
・肥満細胞は同時に、慢性内臓痛の重要な媒介因子である
・モルヒネやコデイン、その他のオピオイドは用量依存性に肥満細胞の炎症促進性サイトカインやサブスタンスPなどを含む脱顆粒を引き起こす。
・ミクログリアもオピオイドに感受性が高く、慢性疼痛における慢性的なオピオイド投与により活性化型となり、CD11bなどを発現する。ミクログリアはμおよびκオピオイド受容体を発現しており、TNFやIL-6,10などのサイトカイン、BDNFなどの放出やプリン受容体やTLR4(Toll-like receptor 4)の発現亢進につながる。いずれも神経炎症に関与しうる
・プリン受容体(P2X4R)活性化に引き続くBDNF放出は、その受容体である脊髄痛覚感受性神経上のTrkB受容体と相互作用し、KCC2(co-transporter 2 of potassium chloride)の発現低下とそれに引き続く塩素イオン恒常性異常につながる。このような病態がオピオイド誘発性痛覚過敏の病態に関与していると考えられている
治療薬候補
・グルタミン酸神経系とNMDA受容体の病的活性化が病態に関与していると考えられており、NMDA受容体拮抗作用を有する薬剤が治療薬候補として提案されている
(1)ケタミン
・ケタミンはNMDA受容体のフェンサイクリジン結合サイトに結合し、拮抗的に作用する
周術期の疼痛管理においてオピオイド投薬時に低用量ケタミンを併用する介入試験のメタ解析では、結果は一定していない。システマティックレビューにおいても、癌性疼痛におけるオピオイド治療の有効性を改善するとのエビデンスを示すことができていない。
・ただし、高用量オピオイドの投薬を必要とするケースや、ある程度のオピオイド耐性が存在するケースにおいては、ケタミンの有用性が示唆する報告もある。今後さらに大規模介入試験での検証を要する
(2)メサドン
・メサドンは弱いNMDA受容体拮抗作用を有する
・メサドンは、高用量オピオイドにより生じたオピオイド誘発性痛覚過敏の症状改善に有効であることが示唆する報告がある。メサドンへのオピオイド・ローテーションが痛覚過敏の改善に有効であったとの複数の報告がある
・ただし、メサドンは高用量においてTorsades de Pointsなど有害性のリスクがあり、またメサドン自体がオピオイド誘発性痛覚過敏を増悪させたとの報告があり、注意を要する
(3)デキストロメトルファン(商品名:メジコン)
・デキストロメトルファンは非競合型のNMDA受容体拮抗作用を有しており、鎮咳薬として使用されている
・しかしながら、MorphiDex(モルヒネ:デキストロメトルファン=1:1の合剤)とモルヒネを比較する、非癌性慢性疼痛に対する3つの大規模介入試験の結果は、有効性に関してMorphiDexとモルヒネの有意差は全く見いだされず、デキストロメトルファンを併用することの有用性は支持されなかった
(4)COX-2阻害剤
・プロスタグランジンは、侵害受容経路を調節することが示されており、脊髄後角において興奮性アミノ酸であるグルタミン酸の放出を刺激することことから、COX阻害剤は、中枢神経におけるNMDA受容体の機能に拮抗することが示されている
・また、COX阻害剤は、動物実験ではオピオイド耐性の発現を抑制することも示されている。したがって、cox-2阻害剤はオピオイド誘発性痛覚過敏の発症を抑制することができるのではないかと考えられていた
・COX-2阻害剤の予防的投与がヒトのオピオイド離脱時の疼痛や、オピオイド誘発性痛覚過敏を緩和するとの報告(Anesthesiology. 2006 Nov;105(5):1016-23.)がある。しかし発症後投与では有効ではなかったとされており、NMDA受容体作動薬ほどオピオイド誘発性痛覚過敏の病態への影響は大きくないと考えられている
(5)α2受容体アゴニスト
・α2受容体アゴニストのクロニジンがオピオイド誘発性痛覚過敏の症状改善に有効であったとの報告がある。しかしラットでの実験では、クロニジン単回投与後に一過性の鎮痛作用がみられたものの、その後遅発性に温度覚への過感受性がみられたとの報告があり、その有効性については動物実験では相反する報告があり、一定していない。
現実的なオピオイド誘発性痛覚過敏への対処
・非癌性疼痛に対するオピオイド使用の際には必要最低限、可能な限り短期間とする。非薬物療法や鎮痛補助薬(デュロキセチン、プレガバリン、ガバペンチンなど)などの使用を
・オピオイド減量の際には急な減量を避ける
・異なるオピオイドを組み合わせるオピオイド・コンビネーションないしオピオイド・ローテーション
・COX-2阻害薬との併用療法
(2)薬物乱用頭痛
・薬物乱用頭痛については、2019年のLancet Neurology誌に総説(Lancet Neurol. 2019 Sep;18(9):891-902)がでていましたので、これを中心にまとめます。
背景
・薬物乱用頭痛(medication overuse headache)は二次的な慢性頭痛であり、鎮痛薬や片頭痛治療薬の頻回使用により生じる
・ICHD-3(International Headache Society)の診断基準では、原発性頭痛に対して1ヶ月間に10日(エルゴタミンとトリプタン)ないし15日以上(鎮痛薬)の薬剤過量使用が3ヶ月以上持続し、その結果、1ヶ月のうち15日以上頭痛を生じるものとされている。
・頭痛以外の慢性疼痛、例えば慢性腰背部痛に対する鎮痛薬の頻回使用は、もともと片頭痛を有する患者の頭痛の頻度を増悪させることが知られている
・診断はrecall biasの影響を受けるため容易ではない。罹患率は報告によりばらついており中間値は1-2%程度。男女比4:1.50-60歳台が最多。
・薬物乱用頭痛のリスク要因としては、社会経済的に低い立場、ストレス、肥満、低活動、喫煙など
・予防することが重要
予防について
・鎮痛薬や片頭痛治療薬の使用を最高で週に2日までに控えるように教育すること
・服薬状況と頭痛について自己記録をすること
・イタリアでの100名の薬物乱用頭痛患者に対する15分間の教育セッション実施により、ベースラインでは平均、1ヶ月間24日間の頭痛と22日間の服薬をしていたが、教育により2ヵ月後に79%の患者が服薬頻度を減少させ、69%が50%以上の頭痛頻度の減少をみた
離脱および予防的治療
・175名の薬物乱用頭痛(片頭痛ないし緊張型頭痛)を対象にした研究で、鎮痛薬など離脱2ヶ月後において、45%が頭痛頻度の50%以上の減少を示したが、48%は不変で、7%が増悪した。改善しなかった88名についてうち80名が薬物療法(片頭痛治療薬などの再開)ないし非薬物療法(誘発因子を避ける、運動、認知行動療法など)に反応し平均26%の頭痛頻度の減少を示した
・デンマークでの小規模試験では、薬物乱用頭痛患者72名を2ヶ月間投薬頻度を週2日までに制限する群と、完全に断薬する群とに無作為割付し、6ヵ月後の状態を評価したところ、断薬群では頭痛頻度が46%減少し、制限群では22%減少し、1ヶ月あたりの片頭痛日数も断薬群では平均7.2日減少し、制限群では3.6日の減少であった。この結果から、二ヶ月間の完全な断薬が、より頭痛頻度の減少に有効であることが示唆された
・COMOESTAS試験は、多施設オープン試験であり、492名の薬物乱用頭痛患者(トリプタン、エルゴタミン、配合鎮痛薬などが原因薬剤)がエントリー(89%が片頭痛)。薬物中断と同時に頭痛予防薬の使用は許可(1-7日目まではアセトアミノフェン1gを1日3回までないしナプロキセン(NSAIDs) 500mgを1日2回まで。8日目以降はこれまでに使用経験のない鎮痛薬は対症治療薬として許可)。最初1ヶ月で頭痛頻度は44%減少し、6ヵ月後には60%減少した。
・片頭痛患者に対するトピラマートの有効性を検証した2つの介入試験があり、アメリカでは306名がエントリー、ヨーロッパでは59名がエントリーし、アメリカではnegative、ヨーロッパではpositiveな結果であった。結果の差異が生じた理由として、アメリカでは薬物乱用頭痛患者が38%、ヨーロッパでは78%であり、アメリカでは乱用薬物はNSAIDsが多く、ヨーロッパではトリプタンであった。従って片頭痛患者の薬物乱用頭痛に対してトピラマートは代替薬として選択肢になりうるかもしれない
・慢性片頭痛患者に対してボトックス(onabotulinumtoxin A)の予防効果(7つの頭頸部筋群の31箇所に計155単位筋注。12週間あけて2回)を検証した介入試験がある。1384名中904名が薬物乱用頭痛患者であり、この患者群について結果を分析したところ(大半がトリプタン)、ボトックスは有意に良好な結果となった(頭痛日数の減少が-8.2日/月(ボトックス)対-6.2日/月(プラセボ))
・慢性片頭痛患者で薬物乱用頭痛を併発した患者に対してfremanezumab(カルシトニン遺伝子関連ペプチド:CGRPをターゲットとするモノクローナル抗体:675mg単回皮下注ないし225mgずつ4週に1回合計3回皮下注)が投与され、プラセボと比較され、12週後に1ヶ月あたりの頭痛日数の変化は単回投与群で-4.7日、3回投与群で-5.2日、プラセボ群で-2.5日で有意差あり。Fremanezumabは片頭痛における薬物乱用頭痛に対して有効。CGRP受容体が片頭痛発症に関連していることが示唆されている
・トピラマート、ボトックス、fremanezumabは、乱用薬物の中断することなく頭痛頻度を減少させており、薬剤からの離脱が困難な患者についても選択肢になりうる
・薬物乱用頭痛患者において、薬剤中断後の頭痛頻度減少に、アミトリプチリンの有効性が小規模の介入試験で示されている(17名の小規模試験。9週後に頭痛頻度はアミトリプチリンで45%減少、プラセボでは28%減少)
離脱症状への治療
・慢性頭痛かつ薬物乱用頭痛を有する患者において、乱用薬物を中断する際に、反跳性頭痛の症状を緩和するために、プレドニゾロン60mg(2日間60mg、その後20mg/dayずつ減量)の有効性を検討したオープン試験では有効性を示唆する結果がえられた(プラセボ対照ではない)が、97名を対象としたプラセボ対照試験では、頭痛頻度などにおいて有効性は確認できなかった。今後さらに検証が必要
・97名の患者を対象に、10日間のセレコキシブないしプレドニゾン投与とを比較した介入試験では、3週後にセレコキシブ群では有意に頭痛強度が減少したが、頻度は有意差なし
まとめ
・慢性頭痛患者については、まずは薬物乱用頭痛を引き起こさないように教育を行う
・薬物乱用頭痛患者に対しては、乱用薬物を中断するか、週に2日までの使用に控えるように指導する。薬剤を使用する場合に、これまで使用した薬剤とは別の薬剤を推奨すべきかどうかは定かでない。薬物からの離脱が困難ないし、離脱しても頭痛が残存ないし増悪の場合には、トピラマート、ボトックス、抗CGRPモノクローナル抗体などが選択肢となりうるかもしれない
(3)ベンゾジアゼピン奇異反応
・ベンゾジアゼピン奇異反応については、本来抗不安作用や鎮静作用を発揮すべきベンゾジアゼピン系薬剤により、却って不安や焦燥感が増悪し、情動易変性や敵意、攻撃性、興奮などを呈する病態とされています。抑うつや躁症状、精神病症状なども奇異反応に含まれるようです。ただ、このような報告は2000年くらいまでの海外の古い文献に多く、今では考えられませんが、海外では超大量のベンゾジアゼピン(ジアゼパム換算で1日40mgとか)が使用されたりした介入試験(例えばJ Clin Psychiatry. 1996 Aug;57(8):349-55)なども存在していたため、ここまで大量に使用すれば、それは耐性でも離脱でも依存でも脱抑制でもせん妄でも、何でもありなような気がしますし、区別すべき病態といえます。
・実際にパニック症に対する8週間の介入試験の論文(J Clin Psychiatry. 1996 Aug;57(8):349-55)では、ジアゼパム平均43mg(n=81)とアルプラゾラム平均4.9mg(n=78)がプラセボ(n=79)と比較されましたが、副作用の表を見てみると、図のようにジアゼパム群、アルプラゾラム群ともに、性欲の減退、食欲の減退と同じか、それ以上の比率で、性欲の亢進(ジアゼパム群では18.5%。プラセボでは3.9%)、食欲の亢進(ジアゼパム群32.1%,プラセボでは14.3%)がみられており、プラセボ群とも有意差があることから、これは奇異反応というよりも高用量ベンゾジアゼピンによる脱抑制と言ってもいいのかもしれません。また思考障害(これが具体的にどのような内容なのかわからなかったですが)の副作用も有意に多くなっており、奇異反応とされうる症状に通じる副作用といえるかもしれません。
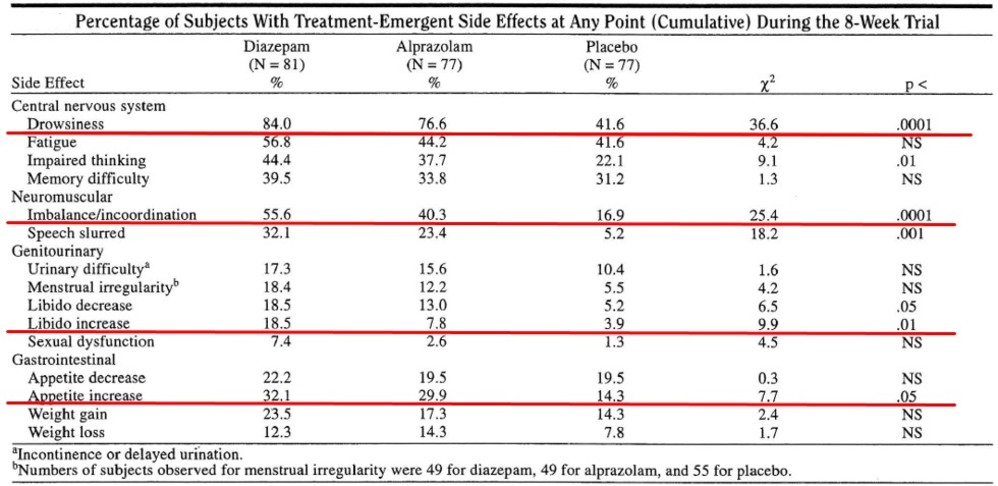
・このように一般には高用量ベンゾジアゼピンでみられうる脱抑制的反応ですが、実際には常用量においても観察されうることには注意が必要です。以前のベンゾジアゼピンに関するブログ記事でも取り上げましたが、ベンゾジアゼピンの長期使用は耐性によりもはや何の効果もなく、むしろ慢性のベンゾジアゼピン投与を受けているケースについては、ベンゾジアゼピンを中断した方が、不安得点や疾患の重症度が改善したとの報告(Br J Psychiatry. 1990 Mar;156:406-11. )もあることなどに注意を要します(離脱の際に一過性に不安などが増悪しうるが、その後改善を示す)。
・一方で、倉田ら(臨床精神薬理 11(2) 253-259, 2008)の報告にあるように、アルコール依存症患者や小児、高齢者、脳器質疾患の合併例など中枢神経系の脆弱性が想定されるケースにおいては、奇異反応出現のハイリスクとされており、ベンゾジアゼピン投与による精神症状の増悪リスクに注意を要します。
・慢性にベンゾジアゼピン投与が継続されている場合、なかなか中止にもっていくことが困難になっているケースも多くあります。
・緊張病やレム睡眠行動障害、むずむず脚症候群、さらには最近の東京医科歯科大学からの興味深い報告(Shiwaku H. et al. J Clin Med. 2020 Jun 21;9(6):1938)として、精神病性うつ病における再発予防の可能性など、ベンゾが活躍しうる臨床場面は確かにありうるのですが、ベンゾジアゼピン系薬剤の使用はできるだけ短期間、必要最低限の用量でということが望ましいといえます




