-
抗うつ薬の作用機序について
2020年09月29日
・セロトニン1A受容体の脱感作とかわざわざそんなめんどくさいことをさせなくても、最初からセロトニン1A受容体アンタゴニストを投与すればいいんじゃないか(臨床試験ではうまくいっていないですが)とか、動物実験ではセロトニン2C受容体アゴニストもアンタゴニストも、セロトニン6受容体アゴニストもアンタゴニストも、いずれも抗うつ薬類似作用を発揮するとか、モノアミン仮説がわからないので、何かよい総説はないかと探してみましたが、2011年の古い物(文献1)しか見当たりませんでした。
・2020年現在にどこまで通じるのかわかりませんし、今となっては間違っている記載が多々あるかもしれませんが、とりあえずは見ておこうということでざっと通してみます。
うつ病動物モデルとセロトニン受容体サブタイプ
背景
・SSRIの登場以前はモノアミン再取り込み阻害作用を有する三環系抗うつ薬ないしモノアミン酸化酵素阻害薬(モノアミンの代謝酵素を阻害する)がうつ病治療に用いられてきた。これら古典的薬剤と比較してSSRIは副作用が少ないため成功してきた
・SSRIはセロトニントランスポーターを選択的に阻害し、そのため全てのシナプス後セロトニン受容体における細胞外セロトニン濃度を上昇させる。SSRI慢性投与は細胞外セロトニン濃度をさらに上昇させるか、維持させる効果がある
・さらにSSRI慢性投与によりセロトニン自己受容体の脱感作や、セロトニントランスポーターの脱感作、受容体の発現低下、神経栄養因子の動員、海馬神経細胞新生の亢進などが報告されている
・1987年のフルオキセチンの承認以降、行動薬理学の分野では、SSRIの薬理作用を動物実験で検証してきたが、古典的動物モデルではSSRIの行動薬理学的作用ははっきりしなかった。というのは、それまでのアポモルヒネ誘発性低体温モデル、レセルピン誘発性眼瞼下垂または低体温モデル動物、または定型的な強制水泳試験のようなモデルは、カテコールアミン系への三環系抗うつ薬ないしMAOIの効果を検証するために開発されたものであったからである。
・これら定型的なモデル動物や試験でSSRIが効果を示さなかったことは臨床効果への疑問につながったが、実際に臨床的有効性が示されてからは、新たな行動試験や動物モデルにおいてその行動薬理学的作用が検証されるようになった。
・このレビューでは、動物行動薬理学的実験によりセロトニン系がどのようにSSRIの抗うつ作用発現に寄与しているかをより正確に理解することである
・中枢神経系では7つの主要なファミリーに属する少なくとも14のセロトニン受容体サブタイプが同定されている。
・現在ではうつ病や不安症におけるSSRIの治療効果には、複数のセロトニン受容体サブタイプが関与していることが明らかになっており、1つの受容体が他の受容体よりもより重要であるかどうかは明らかではない。驚くべきことに、いくつかの5-HT受容体におけるアゴニストおよびアンタゴニストは、詳細なメカニズムは異なるにしても、どちらも抗うつ薬のような行動効果をもたらすことが知られている(例えばセロトニン1Aアゴニストとアンタゴニスト)
・齧歯類を用いたうつ病の行動薬理学的検査は、薬物投与の期間に基づいて、急性試験と慢性試験に分けることができる。急性試験はSSRIの効果が1回または少数回の投与で明らかになる行動試験であり。慢性試験では通常2週間以上の投与を必要とする。
急性試験
・強制水泳試験(FST):ストレスに対する脆弱性の増加ないしうつ病の治療のいずれかと相関するストレスに対する反応の行動パターンを測定する。水(通常は円筒形)の容器にラットを配置し、最初は、ラットが脱出しようとするが、最終的にはラットの鼻を水面に出すことを維持するために必要な動作を除いて、不動(受動的な行動)の姿勢をとるようになる。テストは、2つの水泳暴露で構成され、最初は15分間の暴露であり、24時間後に5分間の暴露を実施する。不動時間は、2回目の5分間の試験中に記録される。FSTでは、抗うつ薬は能動的な対処行動を増加させることにより、不動時間を減少させる。異なるクラスの抗うつ薬の効果を測定したり、変異齧歯動物のうつ病関連行動への影響を評価したりするために最も頻繁に使用されている行動検査。FSTではSSRIの効果を測定することができなかったため、LuckiらはFSTの手順とスコアリングを改変した。水深が深くし、シリンダーが大きくすることにより、自由遊泳を可能にした。定型的なFSTでは、動けない状態で過ごした時間の合計のみを採点していたが、修正版FSTでは、5分間の試験で泳ぎと登りの頻度を測定するスコアリングシステムが導入された(水泳は、チャンバー全体の水平方向の動きとして定義され、上昇行動は、チャンバーの前足の垂直方向の動きとして定義)。修正ラットFSTでは、ストレスに対する受動的反応(不動)と能動的反応(水泳や上昇行動の増加)を区別する。フルオキセチン、セルトラリン、パロキセチン、シタロプラムなどは水泳行動を選択的に増加させ、ノルアドレナリン作動系薬剤は上昇行動を選択的に増加させる。セロトニン系、ノルアドレナリン双方の作用を持つ薬物は水泳と上昇行動の両方を増加させる
・テールサスペンション試験(TST):テールサスペンション試験は、より簡便で、かつマウスの抗うつ薬に対する行動反応を、FSTと同様の行動原理に基づいて、迅速に試験する方法。この試験では、マウスを粘着テープで尻尾を棒に固定して吊るす。6分間のテストの間、マウスが動かずに過ごした時間は、うつ状態に似た行動の指標になる。TSTは、FSTにおける冷水による低体温効果がないこと、泳ぐことを困難にする運動障害を有するモデルを試験できることなどFSTに比べて多くの利点がある
・低反応率分化強化(DRL)行動試験:低反応率分化強化スケジュールは先の反応から一定時間経過した最初の反応を強化する手続き。定められた反応時間よりも長い反応間時間を分化強化し、定められた反応時間未満での反応では報酬は得られない。72秒以上の反応間時間を持つ応答を強化するスケジュールの下で維持されたオペラント行動は、抗うつ薬に対する特異的な感受性を示す。SSRIを含む抗うつ薬は、このスケジュールの下で応答するラットの応答速度を低下させ、強化率を増加させる。このような強化は抗うつ薬に特異的な反応
・薬物弁別試験:薬物弁別試験は、ラットに訓練薬を投与した場合にのみ、特定のレバーの上で与えられる餌の報酬に反応するように訓練するもの。薬物の相互受容特性の判別に用いられる。この手法は、依存性薬物の研究に最もよく用いられている。シタロプラムが識別刺激として訓練された場合、セルトラリンとパロキセチンには反応したが、ジアゼパムやクロザピンは反応しなかった。薬剤の類似性の判別に用いられる
慢性試験
・慢性的軽度ストレス(CMS)試験:慢性的軽度ストレスモデルの根拠は、環境的ストレス因子、特に予測不可能で制御不能なストレス因子への曝露が、うつ病を発症リスクを高めるという仮説である。 ストレス因子への馴化を防ぐために、不規則に投与される軽度のストレス因子(例えば、ストロボ照明、汚れたケージ、光周期の変調など)が用いられる。数週間にわたって慢性ストレスが投与された場合に、ヒトのうつ病に似たような行動および内分泌学的変化がラットおよびマウスに生じうることが報告されている。CMSによる一般的な行動偏倚は甘味水溶液の消費量減少などの無気力症の出現である。さらにFST行動、睡眠変化、グルーミング、運動量の変化は、CMSによる病理学的変化がより多様であり、CMSがうつ症状の多くをモデル化している可能性を示唆する。CMSによって引き起こされた変化は、多くの抗うつ薬、特にフルオキセチン、セルトラリン、シタロプラムの慢性的投与によって、改善がみられる。ただしCMSに曝露されたすべてのげっ歯類が病理学的な行動変化を示すわけではなく、CMSに反応したすべての動物が抗うつ薬投与後に改善を示すわけではない。このような反応性の個人差はヒトのうつ病にも見られる。CMSの欠点の1つは、異なる実験環境において抗うつ効果の再現性が乏しい場合があることである。
・嗅球摘除術(OB):嗅球の両側摘除は、げっ歯類に重度の行動的および内分泌的変化を引き起こしうつ病モデルとして使用されてきた。OBモデルでみられる最も一般的な行動変化は、オープンフィールド装置における活動亢進である。これらの変化は、SSRIのフルオキセチン、パロキセチン、セルトラリン、およびフルボキサミンを含む慢性的な抗うつ薬投与によって改善する。OBは、扁桃体や海馬など、嗅球に投射したり、嗅球から投射を受けたりする多くの領域で神経変性を引き起こす。OBは、縫線核における神経細胞の損失を引き起こし、セロトニン神経伝達の異常につながる可能性がある。うつ病患者では対照群に比べて嗅覚検出閾値が高く、嗅覚課題のパフォーマンスがうつ病の重症度と逆相関しているという報告は、OBモデルがうつ病と多くの生理学的特徴を共有している可能性があることを示唆している
・Novelty-suppression of feeding(NSF)テスト/novelty-induced hypophagia(NIH)テスト:新奇な環境では,餌を与えた時に摂食するまでの時間が長くかかる。明るく開放的な新奇環境に齧歯類を置き、食べ物に近づくまでの潜時と、新奇環境で消費される食べ物の量を測定する。NSF試験では、消費を促進するために食物欠乏を用いるのに対し、NIH試験では食物欠乏なしで例えば甘味があるような好まれる食物を用いる。新奇環境に曝露することで、食物への接近潜時が増加し、従来環境に比べて餌消費量が減少する。ベンゾジアゼピンなどの抗不安薬は、従来環境での行動を変化させることなく、新奇環境での食物への接近潜時を減少させ、餌消費量を増加させる。SSRIは、ラットおよびマウスに慢性投与された場合、これらの試験において抗不安薬と同様の効果をもたらすことが知られている。NSFおよびNIHテストは、慢性抗うつ薬治療の抗不安効果に敏感な数少ない行動テストの一つ
・社会的敗北ストレステスト:マウスをより大きなマウスのいるケージで共存させることにより、抑うつ関連行動をおこさせる。数週間社会的ストレスを受けたラットは、FSTでの運動量の減少、ショ糖嗜好性の減少、不動時間の増加などを示す。シタロプラムまたはフルオキセチンを慢性的に投与すると、動機付けと報酬感受性に関連した行動が正常化される. 長時間社会的敗北に曝露されたマウスは、強い回避反応を示し、他のマウスとの交流に費やす時間が減少する。フルオキセチンまたはイミプラミンを4週間慢性投与すると、社会的相互作用が改善する。
u学習性無力モデル:学習性無力とは、逃れられないストレスにさらされた動物が、REM睡眠の変化、体重減少、性的行動の減少、CRFおよびコルチゾール濃度の上昇など、ヒトうつ病に類似した病態を示すもの。脱出不可能なストレスに曝露された学習性無力状態では、その後、脱出が可能な状況であっても脱出することをしなくなる。電気ショックなどを用いて学習性無力状態が作り出される。SSRI慢性投与により、逃走までの潜伏期間が短縮されたり、学習性無力を発現する動物の数が減少したりする。SSRIの行動学的影響における内因性セロトニン系の役割
・齧歯類における行動研究ては、セロトニン合成を阻害することによりうつ病の行動的特徴を再現することに成功していない
・ラットやマウスに対して、トリプトファン水酸化酵素阻害剤であるパラクロロフェニルアラニン(PCPA)投与によりセロトニン合成を阻害しても、強制水泳テストにおける行動的特徴に影響を与えることができないことが知られている(Gavioliら 2004)。さらに神経毒によりセロトニン神経を破壊しても、ラットに強制水泳テストにおいて不動時間の増加がみられないことが報告されている(Luckiら 1994)
・近年、トリプトファン水酸化酵素の遺伝子(tph1遺伝子およびtph2遺伝子)に変異を有するマウスにおいてうつ病的な行動表現型がみられることが報告されている。いずれの遺伝子もセロトニン合成を制御しており、Tph1遺伝子は主として末梢組織に、tph2遺伝子は主に神経細胞におけるセロトニン合成に関与している。tph2遺伝子ノックアウトマウスでは、テールサスペンションテストにおける不動時間の延長が報告された(Savelievaら 2008)。また中枢神経でのセロトニン合成能が80%低下する変異tph2遺伝子をマウスにノックインすると、テールサスペンションテストにおいて不動時間が有意に延長することが報告された(Beaulieuら 2008)。しかしこれらの研究の結果は、セロトニン系が発生時に重要な役割を果たしている可能性を除外できない
・tph2遺伝子多型(セロトニン合成速度が変化する)が強制水泳テストにおけるSSRIに対する反応性を修飾する可能性が報告されているが、この報告については再現性が確認されておらず、また強制水泳テスト以外の試験においての検証はなされていない
・セロトニンの枯渇がモデル動物におけるうつ病行動特性を誘発するとは限らないが、強制水泳テストやテールサスペンションテストにおいてSSRI投与が効果的であるためには、セロトニン系の機能が保持されていることが重要であると考えられている。その根拠として、パラクロロフェニルアラニン(PCPA)を投与すると、強制水泳テストやテールサスペンションテストにおけるフルオキセチンの効果は阻害されるが、ノルエピネフリン再取り込み阻害剤であるデシプラミンの効果はPCPA投与の影響を受けないことがあげられる。この結果は急性試験におけるSSRIの効果がセロトニン系を介することを支持するものである
・学習性無力モデルラットを用いた実験において、セロトニン1A受容体遮断薬(WAY100,635)投与下において、セロトニン1A受容体アゴニストを投与すると、無力行動の改善はみられなくなったが、フルオキセチンおよびパロキセチンによる無力行動の改善効果は保持されていた。またPCPA投与によりセロトニンを枯渇させても、無力行動は変化せず、フルオキセチン、パロキセチンの無力行動改善効果は保持されていた(Zazpeら 2007)。PCPAのSSRIへの影響は急性試験と慢性試験で異なるのかもしれない
・一酸化窒素は多くの中枢神経系受容体の細胞内メッセンジャーである。一酸化窒素合成酵素(NOS)を阻害することによってNOシグナルを減少させると、ラットの強制水泳テストにおいて抗うつ薬様の効果が得られることが示されている。これらの行動効果は、PCPAを用いたセロトニンの枯渇によって阻害されるため、NOS阻害による行動効果はセロトニン系に依存していることが示唆されている。また亜鉛投与は、多くの動物モデルおよび予備的臨床研究において、抗うつ薬に類似した効果をもたらすことが報告されている。PCPAを投与すると、亜鉛の抗うつ薬様効果が阻害されることが報告されている。
セロトニン1A受容体
・特異的なリガンドを用いた受容体オートラジオグラフィーによりセロトニン1A受容体は海馬や外側中隔などの辺縁系や大脳皮質のシナプス後膜において高密度に発現していることが報告されている。中隔に存在する受容体はコリン放出を制御し、前頭前野においてはグルタミン酸放出を制御し、腹側被蓋野ではドパミン放出を制御している。これらの領域における細胞内シグナル経路は主としてGi/o蛋白質とカップリングし、アデニル酸シクラーゼの活性を抑制している。
・同時にセロトニン1A受容体は脳幹部や延髄縫線核の神経細胞の細胞体や樹状突起に位置し、神経発火やセロトニン合成、シナプス末端からのセロトニン放出を抑制する機能を有する。
・セロトニン1A受容体は不安やうつ症状、体温調節、コルチコステロン分泌、学習と記憶に関与していると考えられている。
・セロトニン1A受容体の部分アゴニストであるブスピロン、イプサピロンは抗不安薬として上市されている。またセロトニン1A受容体機能の障害がうつ病患者において報告されている(Savitzら2009)
・セロトニン1A受容体のプロモータ領域におけるある種の遺伝子多型はうつ病や不安障害のリスク因子として同定されており、SSRI治療抵抗性に関与していることが報告されている
・セロトニン1A受容体アゴニストは抗うつ薬類似効果を発揮することが、各種の動物実験において報告されている。セロトニン1A受容体アゴニスト(8-OH-DPAT)や部分アゴニスト投与(ブスピロンなど)はラット強制水泳試験における不動時間を減少させ、同時にセロトニン1A受容体阻害薬による前処置により、その作用が阻害されることが報告されている。
・セロトニン1A受容体アゴニストは、学習性無力モデル、低反応率分化強化(DRL)行動試験においても抗うつ薬類似作用を発揮し、セロトニン1A受容体部分アゴニストは慢性的軽度ストレス(CMS)試験、嗅球摘除試験において抗うつ薬類似作用を発揮することが確認されている。またセロトニン1A受容体アゴニストないしブスピロンの慢性投与はnovelty-induced hypophagiaテストにおいて食べ物への近接潜時を短縮させ、歯状回における神経新生を増加させ、神経細胞の生存を促進することが報告されている。
・しかしながら、臨床的にはブスピロンとイプサピロンを除いて、セロトニン1A受容体アゴニストの抗うつ薬としての開発は成功していない
・SSRIやその他の抗うつ薬の慢性投与、ECTは、シナプス前およびシナプス後膜のセロトニン1A受容体の反応性を変化させる。海馬などの辺縁系において抗うつ薬の慢性投与はセロトニン1A受容体を介したシナプス伝達の促通が生じることが報告されており、抗うつ作用におけるシナプス後膜のセロトニン1A受容体の関与が重要であることを示唆している
・同時に週単位の抗うつ薬投与後に生じるセロトニン1A自己受容体の脱感作が、セロトニン伝達の増強における重要な要因であり、抗うつ作用が遅れて生じることの根拠となっている。縫線核におけるセロトニン1A受容体を阻害すると、セロトニン放出の脱抑制を引き起こし、抗うつ作用を増強することが報告されており、セロトニン1A受容体阻害薬は抗うつ薬の増強療法の候補として提唱されている(臨床試験ではうまくいっていない)。セロトニン1Aおよび1B受容体拮抗薬であるピンドロールは動物実験ではSSRIとの併用で抗うつ作用を増強させることを示唆する結果が得られており、ヒトに対して抗うつ薬との併用での治療抵抗性うつ病に対する臨床試験が行われたが、結果は芳しくないものであった(明確な有効性を示せていない)。ピンドロールは高用量においてはシナプス後セロトニン1A受容体作用によりSSRIの治療効果を阻害する可能性が報告されており、シナプス前受容体阻害作用とのトレードオフが生じる可能性が報告されている。
・新規抗うつ薬のビラゾドンはセロトニン1A受容体部分アゴニスト作用をSSRI作用を併せ持つ薬剤であり、ラットの大脳皮質および海馬においてフルオキセチン単独よりも細胞外セロトニン濃度を上昇させることが報告されている。またラットおよびマウスの強制水泳試験において抗うつ薬類似作用を発揮することが報告されている。しかし細胞外セロトニン濃度を上昇させることの臨床的意義ははっきりしていない(ビラゾドン自体の臨床的抗うつ作用は他剤と比較して有意に優れているというわけではない)。
・セロトニン1A受容体ノックアウトマウスの共通した特徴は不安特性の高い行動特性である。この特性はは発達段階でのセロトニン1A受容体の欠如により引き起こされると考えられており、成熟後にセロトニン1A受容体欠失を生じさせたマウスではそのような行動特性が生じなかったことが根拠である。セロトニン1A受容体ノックアウトマウスでは、正常なセロトニン放出を示すが、セロトニン1A自己受容体欠損のため、フルオキセチン投与後のセロトニン濃度の上昇が増加する。しかしながらセロトニン1A受容体ノックアウトマウスにおいてはSSRI投与に対して治療抵抗性を示す。このことはおそらくシナプス後膜のセロトニン1A受容体が欠損していることに起因すると考えられている。
・セロトニン1A自己受容体の密度が高いマウスは、ベースライン時の強制水泳試験とテールサスペンション試験での不動時間の増加など、ストレス因子に対する応答が増強した。また、セロトニン1A自己受容体の密度が低いマウスでは、フルオキセチンによる海馬の細胞外セロトニン濃度の上昇が増強され、 novelty-induced hypophagia試験において慢性的なフルオキセチン投与に対しより迅速な反応を示した。
・セロトニン産生神経細胞を破壊ないしセロトニン合成が阻害されても、セロトニン1A受容体アゴニスト投与は抗うつ薬類似作用を発揮することが報告されている。このことは、抗うつ作用の発揮がシナプス後膜のセロトニン1A受容体を介したものであることを示唆するものである
・結論として、シナプス前膜のセロトニン1A受容体はうつ病関連行動のリスク因子となり、同時にその阻害がSSRIの作用を増強する可能性がある(この仮説は現時点では臨床的には否定的だが)。またおそらくSSRIおよびセロトニン1A受容体アゴニストの抗うつ作用はシナプス後膜のセロトニン1A受容体を介したものであることが推測される
セロトニン1B受容体
・セロトニン1B受容体は基底核、側坐核、黒質などで高密度で発現する他、帯状回、海馬、扁桃体などでも多く発現がみられている。セロトニン1B受容体はセロトニン神経末端での自己受容体としての機能と、非セロトニン神経系におけるヘテロ受容体として、その神経の伝達物質の放出を制御する機能とを有する。
・セロトニン1B受容体は、片頭痛、運動活動、薬物嗜癖、攻撃性、うつ病、不安などに関与していると考えられている。
・セロトニン1B受容体は、環境ストレスへの曝露や抗うつ薬投与によって制御されるため、うつ病の治療標的となりうる。学習性無力状態では皮質や海馬、中隔、背側縫線核でのセロトニン1B受容体の発現亢進をもたらすことが報告されており、抗うつ薬の慢性投与は背側縫線核でのセロトニン1B受容体mRNA減少と、セロトニン1B自己受容体の効力を減少させ、その結果セロトニン放出の増加につながることが報告されている。
・顆粒細胞や錐体細胞に存在するセロトニン1Bヘテロ受容体は海馬神経新生の増加に関与していることが報告されている(Banasrら 2004)
・同時にセロトニン1B受容体は結合蛋白質p11により制御されている。P11はセロトニン1B受容体の機能を増強することが知られている。マウスでの抗うつ薬治療はp11を増加させ、同時にp11を過剰発現させるようにしたトランスジェニックマウスでは抗うつ薬類似作用を発揮することが報告されている。またp11遺伝子除去したマウスでは強制水泳試験やテールサスペンション試験において不動時間が増加し、うつ病類似行動が引き起こされることが報告されている。
・セロトニン1B受容体アゴニスト投与はマウスの強制水泳試験において抗うつ薬類似作用を発揮することが報告されている。この効果はセロトニン1B受容体除去およびアンタゴニスト投与により阻害されたが、セロトニン除去によっては阻害されなかった。このことはセロトニン1Bアゴニストによる抗うつ作用がシナプス後膜セロトニン1B受容体を介したものであることを示唆している。
・セロトニン1B受容体アンタゴニスト投与は、シタロプラムおよびパロキセチンの抗うつ作用を阻害することが報告されており、これら薬剤の治療的効果の一部はセロトニン1B受容体を介したものである可能性がある
・他のグループは、シナプス前セロトニン1B自己受容体が抗うつ作用発揮に必要であることを主張している。セロトニン1B受容体アンタゴニストをパロキセチンと同時投与するとラットの強制水泳試験におけるパロキセチンの抗うつ作用が増強したが、フルオキセチンないしシタロプラムと併用した場合には抗うつ作用の増強はみられなかった。またセロトニン1B受容体アンタゴニスト単独投与は、細胞外セロトニン濃度を上昇させ、抗うつ薬類似作用を発揮し、抗うつ薬の作用を増強することも報告されている。
・これらの作用はおそらくはセロトニン1B自己受容体の阻害によるセロトニン放出の脱抑制に起因したものであろう。研究グループ間の異なった結論は、セロトニン1B受容体がヘテロ受容体および自己受容体とで異なる機能を有することに起因する可能性があり、あるいは研究室間の手技の違いなどに起因するものかもしれない。
セロトニン2A受容体
・セロトニン2A受容体は大脳皮質、梨状皮質、嗅内野、前障、嗅球、前嗅核や多くの脳幹核において高密度に発現している。辺縁系や基底核においても中等度の発現がみられる。セロトニン2A受容体はGq/11蛋白質とカップリングしており、IP3/PKC経路につながっている。
・セロトニン2A受容体アゴニストはLSDなどの催幻覚剤の効果発現と関連している。SSRIなど抗うつ薬の慢性投与は齧歯類において、前頭皮質におけるセロトニン2A受容体密度の減少につながり、おそらくこのことと抗うつ作用との関連が推測される。うつ病患者においてはセロトニン2A受容体密度の増加が報告されている。またセロトニン2A受容体遺伝子多型とSSRIへの治療反応性との関連も報告されている(McMahonら 2006)。
・選択的なセロトニン2A受容体アンタゴニストは強制水泳試験において抗うつ薬類似作用を発揮することが報告されており、セロトニン2A受容体アンタゴニストの慢性投与は嗅球除去モデルにおいて強制水泳試験や社会的相互作用テストなどでの抗うつ薬類似作用が報告されている
・SSRIにセロトニン2A受容体アンタゴニストを併用するとオペラント行動を用いたテストにおいて抗うつ作用が増強することが報告されている。この作用機序としては、セロトニン2A受容体アンタゴニストがSSRIによる細胞外セロトニン濃度増加をさらに増強することによる可能性が推測されている
・セロトニン2A受容体アンタゴニストは、その他の神経伝達物質の放出を制御することにより抗うつ作用を発揮する可能性が報告されている。例えばセロトニン2A受容体アンタゴニストは前頭前野でのドパミン放出を抑制IS、一方でアゴニストはドパミン活性を亢進させることが報告されている。またセロトニン2A/2C受容体アゴニストであるDOI投与は、皮質ではグルタミン酸放出を増加させることが報告されている。非定型抗精神病薬によりセロトニン2A受容体遮断すると、SSRIによりもたらされた青斑核での神経発火抑制が、改善することが報告されており、治療抵抗性うつ病における非定型抗精神病薬増強の治療的有用性の根拠となっている。
セロトニン2C受容体
・セロトニン2C受容体は受容体オートラジオグラフィーにより当初は脈絡叢に見いだされ、その後海馬や扁桃体、前嗅核、 endopiriform nucleus、帯状回、梨状回、視床核、黒質などでの存在が同定された。セロトニン2C受容体は主にGq/11蛋白質とカップルし、イノシトールリン酸を増加させ、細胞内カルシウム濃度を増加させる。セロトニン2C受容体を介した薬理作用は複雑であり、その理由としてセロトニン2C受容体が多くの神経系に発現する受容体であり、薬剤の慢性投与によるダウンレギュレーションなどの制御様式も定型的なものではないからである。
・ミアンセリン、ミルタザピン、トラゾドン、ネファゾドンはセロトニン2C受容体に高い親和性を有する。またSSRIはフルオキセチンを除いてはこの受容体への親和性は乏しい。いくつかの非定型抗精神病薬もセロトニン2C受容体遮断作用を有しており、細胞外ノルエピネフリン、ドパミン濃度を増加させ、SSRIによる細胞外セロトニン濃度の増加を増強する。
・セロトニン2C受容体アゴニストはラット強制水泳試験、社会的ストレスモデル、嗅球除去モデルなどにおいて抗うつ薬類似作用を発揮することが報告されている。さらに選択的セロトニン2C受容体アンタゴニストはラット強制水泳試験におけるフルオキセチンの治療的効果を阻害することが報告されている。
・しかしながら、セロトニン2C受容体遮断薬であるミアンセリンは強制水泳試験において抗うつ薬類似作用を発揮する。この作用はおそらくはα2受容体遮断を介したものと推測されている。
・マウスの強制水泳試験においては、セロトニン2C受容体アゴニストは、閾値下用量のイミプラミン、パロキセチン、シタロプラム、フルボキサミン投与により抗うつ薬類似作用を増強させる。しかし通常用量のパロキセチンおよび高用量フルボキサミンとの併用により、抗うつ薬類似作用が阻害される。
・セロトニン2C受容体アンタゴニストが抗うつ作用を発揮することの十分な根拠がある。ミアンセリンやミルタザピンはセロトニン2C受容体阻害薬であり、アゴメラチンはメラトニン受容体アゴニストでありかつセロトニン2C受容体のアンタゴニストである。いずれも抗うつ薬としての有効性が報告されている。
・S32006はセロトニン2C受容体阻害薬であり、ラット強制水泳試験で不動時間を減少させ、慢性投与により、慢性的軽度ストレス試験においてアンヘドニアを減少させることが報告されている。
・セロトニン2C受容体アゴニストとアンタゴニストがいずれも抗うつ作用を発揮することは逆説的であるが、セロトニン2C受容体アゴニストとアンタゴニストがそれぞれ異なるメカニズムで抗うつ作用を発揮していると考えることも可能である。例えば、セロトニン2C受容体刺激はSSRIによるシナプス後セロトニン受容体刺激の主要な構成要素である可能性があり、一方でセロトニン2C受容体アンタゴニストは、セロトニン以外のノルエピネフリンやドパミンなどのその他の神経伝達物質放出を促進することにより、抗うつ作用を発揮しているのかもしれない。
セロトニン3受容体
・セロトニン3受容体はイオンチャネル型受容体である。セロトニン3受容体は迷走神経背側複合体に高密度で発現しており、この部位での受容体遮断は制吐作用を発揮する。その他海馬、扁桃体、皮質などで発現がみられる。セロトニン3受容体はGABA介在神経を活性化することにより間接的に皮質錐体細胞を抑制する。
・オンダンセトロンによるセロトニン3受容体遮断は抗うつ薬類似作用を発揮することが報告されている。さらに低用量SSRIとオンダンセトロン併用はマウス強制水泳試験における治療効果を増強させることが報告されている。一方で、セロトニン3受容体アゴニストは抗うつ作用を減弱させることが報告されている。フルオキセチンなどいくつかの抗うつ薬は機能的にセロトニン3受容体遮断作用を有するといわれている
セロトニン4受容体
・セロトニン4受容体は辺縁系に広く分布している。中隔、海馬、扁桃体などに分布する。セロトニン4受容体アゴニストは、おそらくアセチルコリン放出を制御する作用と関連する、記憶を促進する作用において注目されている。
・セロトニン4受容体アゴニスト(RS 67333)はわずか3日間の投与でセロトニン1A受容体の脱感作を生じさせ、抗うつ薬類似作用をもたらすことが報告されており、速やかな効果発現をもたらすことができる可能性がある。RS 67333をフルボキサミン、シタロプラム、フルオキセチンと同時投与すると、単独投与時と比較して強制水泳試験における抗うつ作用が増強することが報告されている。
・P11ノックアウトマウスではRS 67333投与による抗うつ作用がみられなくなったことから、セロトニン1B受容体同様に、p11がセロトニン4受容体を介した治療的効果の発現に重要である可能性がある
セロトニン6受容体
・セロトニン6受容体は線条体、側坐核、嗅結節に高密度で発現し、扁桃体や視床下部、視床、小脳、海馬などでも発現がみられる。セロトニン6受容体はアセチルコリン、ノルエピネフリン、GABA、ドパミンなど様々な神経伝達物質の放出の制御に関与している。
・クロザピン、オランザピン、クエチアピン、クロミプラミン、アミトリプチリンなどの薬剤はセロトニン6受容体阻害作用を有する。セロトニン6受容体のアゴニストおよびアンタゴニストは双方ともに齧歯類において認知機能増強作用や、SSRIの効果増強作用が報告されている
・マウスやラットにおいてセロトニン6受容体アゴニストにより抗うつ作用、抗不安作用がみられることが報告されている。セロトニン6受容体アンタゴニストも強制水泳テストにおいて抗うつ薬の不動時間減少作用を増強することが報告されている。このパラドックスについても、セロトニン2C受容体と同様に、セロトニン6受容体が様々な神経系への作用に関与しているためではないかと考えられている
セロトニン7受容体
・セロトニン7受容体はGs蛋白質を介してcAMP産生を増加させる。視床核、辺縁系、皮質に高密度で発現し、感覚と情動プロセスに関与していることを示唆している。また視交叉上核にも発現しており、睡眠と概日リズムにも関与していると考えられている。また体温調節についても関与している。
・セロトニン7受容体アンタゴニスト投与ならびにセロトニン7受容体遺伝子除去など、セロトニン7受容体の機能低下をもたらすことにより抗うつ薬類似作用がみられることが報告されている。セロトニン7受容体阻害薬は抗うつ薬増強療法として治療的有効性が期待できる可能性がある。セロトニン7受容体アンタゴニストとシタロプラムの同時投与により、マウスのテールサスペンション試験における治療効果増強が報告されている。アミスルプリドは抗うつ薬類似作用を発揮することが知られているが、この作用はセロトニン7受容体阻害を介したものであるかもしれない。
コメント
急性試験で生じた行動変化がほんとうにうつ病モデルと考えてよいのかはわからないです。PTSDモデルのような気がしなくもないのですが。
齧歯類の方がレジリエンスの観点からもヒトよりも優れていそうな気もするのですが、in vivoでトランスミッターレベルで定量化できるような技術が開発されれば、また何か違うものが見えてくるのかもしれません。
引用文献
The role of serotonin receptor subtypes in treating depression: a review of animal studies
Gregory V. Carr and Irwin Lucki
Psychopharmacology (Berl). 2011 February ; 213(2-3): 265–287. doi:10.1007/s00213-010-2097-z.
-
過食性障害の介入試験
2020年09月22日
・過食性障害(binge eating disorder)に対する新たな介入試験の結果が報告されました(文献1)
・過食性障害は代償行為を伴わず、神経性過食症(bulimia nervosa)は代償行為(下剤乱用や自己誘発性嘔吐)を伴う点で異なります。
・今回報告されたdasotralineは既に2019年に過食性障害に対する新薬承認申請がFDAにより受理されており、審査結果が注目されます。
・現在までにFDAにより摂食障害に対して承認されている薬剤は、神経性過食症(代償行為あり)に対するフルオキセチンと成人期過食性障害(代償行為なし)に対するリスデキサンフェタミン( Lisdexamfetamine dimesylate)のみであり、まずはこれら2剤のエビデンスについて、文献2によりみていきます。
神経性過食症と過食性障害の薬物療法の安全性について
背景
・摂食障害に対する標準的な治療法は、認知行動療法および対人関係療法と考えられている
・精神療法と薬物療法を併用することの有用性ははっきりしていない。
・神経性無食欲症については、フルオキセチンやその他のSSRIとCBTを組み合わせることは、CBT単独と比較して治療的な有用性がないという強いエビデンスがある
・現在のところ神経性無食欲症に対してFDAが承認した薬剤はない
・神経性過食症および過食性障害に対してFDAが承認している2剤についての有効性と安全性のエビデンスを概観する
神経性過食症に対するフルオキセチン
・1994年にFDAはフルオキセチンを神経性過食症に適応承認した
・387名の女性神経性過食症患者を対象とした多施設介入試験(Fluoxetine Bulimia Nervosa Collaborative Study Group)では、フルオキセチン20mgないし60mgの有効性が8週間、プラセボ対照で検証された。フルオキセチン60mg群では過食エピソードはベースラインと比較して67%減少し、嘔吐エピソードは56%減少した。プラセボ群では過食エピソードはベースラインから33%減少、嘔吐エピソードは5%の減少であり有意差を認めた。フルオキセチン20mg群では嘔吐エピソードの減量のみ有意差があり、ベースラインから26%の減少であった。
・別の介入試験(Goldsteinら)では、398名の神経性過食症患者(女性が96.2%)が対象となり、16週間以上でフルオキセチン60mgの有効性がプラセボ対照で検証された。フルオキセチン60mg群ではベースラインと比較して過食エピソード、嘔吐エピソードともに50%減少し、プラセボ群では過食エピソードは18%減少、嘔吐エピソードは21%減少と有意差を認めた。
・維持療法におけるフルオキセチンの有効性も報告されている(Romanoら)。まずオープン試験で8週間232名の神経性過食症患者に対してフルオキセチン60mgが投与され、反応群(150名)が、フルオキセチン継続群(N=74)とプラセボ群N=74(N=76)に無作為割付され52週間経過観察された。過食嘔吐の再燃率は3か月時点でフルオキセチン群19%、プラセボ群37%で有意差を認めたが、6か月、12か月時点では有意差は認めなかった
・安全性については、8週間の試験では、フルオキセチン20mg群では不眠が17.8%、60mg群では不眠が23.2%、プラセボ群では7.8%で有意差あり。振戦は20mg群で3.1%、60mg群では9.03%、プラセボ群で0%で有意差あり。副作用による中断率は5%未満であった
・16週間の試験における安全性については、不眠が60mg群で34.5%(プラセボ群:18.6%)、嘔気が60mg群で30.4%(プラセボ群:12.7%)、脱力感が60mg群で21.3%(プラセボ群:6.9%)、不安が60mg群で17.6%(プラセボ群;8.8%)、振戦が60mg群で14.2%(プラセボ群:2.0%)、浮動性めまいが60mg群で12.5%(プラセボ群:3.9%)、あくびが60mg群で12.2%(プラセボ群:0%)、発汗が60mg群で9.5%(プラセボ群:2.0%)、性欲減退が60mg群で6.4%(プラセボ群:1.0%)。副作用による中断は60mg群10.8%(プラセボ群:5.9%)などであった
・52週間の試験では、反応群のみが対象となったこともあり、鼻炎のみが有意に多い副作用であった(フルオキセチン群 31.6%、プラセボ群 16.2%)
過食性障害に対するリスデキサンフェタミン
・2019年に日本でも小児期ADHDに承認された商品名ビバンセ。デキストロアンフェタミンのプロドラッグ。
・リスデキサンフェタミンはFDAにより2007年に6-12歳のADHDに、2008年に成人ADHDに承認。2015年にはFDAにより中等度から重度の過食性障害の維持療法に承認
・260名の過食性障害を対象とした第2相試験では11週間で(最初3週間で漸増し、その後8週間は30mg、50mg、70mgないしプラセボの固定用量)評価され、過食頻度が50mg群ではベースラインから平均4.1回/週減少、70mg群ではベースラインから平均4.6回/週減少(プラセボ群では3.3回/週の減少)とプラセボ群に比較して有意な減少を認めた
・2つの第3相試験でも11週間(3週間漸増、8週間固定。50mg、70mgないしプラセボ)で行われ(試験1がN=383、試験2がN=390)、過食頻度が実薬群ではベースラインから3.87日/週(試験1)、3.92日/週(試験2)減少し、プラセボ群の2.51日/週減少(試験1)、2.26日/週減少(試験2)より有意に過食頻度が減少した。
・安全性については、第2相試験における副作用による中断率はリスデキサンフェタミン群3.1%であり、1.5%に重大な副作用がみられた。1名がメタンフェタミン過量摂取による死亡。口喝が30mg群の33.3%、50mg群の33.8%(プラセボ群:7.9% )、プラセボに対する体重減少率が30mg群で3.28%、50mg群で5.2%、70mgで5.28%であった。
・第3相試験では、副作用による中断率はプラセボと有意差なく、口喝、頭痛、不眠が10%以上の実薬群にみられた。心拍数は平均4.41-6.31回/分増加し、収縮期血圧は0.2-1.45mmHg増加、離脱症状についてはAmphetamine Cessation Symptom Assessmentにて評価されたが、12週間の投与により有意な離脱症状スコアのプラセボに対する増加はみられなかった
神経性無食欲症
・低用量テストステロン(J Clin Endocrinol Metab. 2019 Oct 1;104(10):4347-4355.)のプラセボ対照比較試験はネガティブ
・152名を対象とした16週間のオランザピン(最大10mg、平均7.77mg)のプラセボ対照比較試験(Am J Psychiatry. 2019 Jun 1;176(6):449-456.)が行われ、脱落数(OLZ 34名対プラセボ 35名)、入院率(OLZ 10.7%対プラセボ 3.9%)いずれも有意差なし。BMIについてはオランザピン(0.259/月)がプラセボ(0.095/月)よりも有意に増加率が高かった。しかしYBOCSやEDE得点の体重への関心などについては有意差なし。食事への関心はオランザピンで有意に増加。オランザピンは体重を増やす効果はあるかもしれないが、精神症状の改善は有意なものはみられなかった
過食性障害に対するdasotralineの有効性と安全性
背景
・過食性障害は最も頻度の高い摂食障害であり、生涯罹患率は女性で1.3-3.5%、男性で0.4-2.0%と報告されている・過食性障害は、20代を発症のピークとする慢性疾患であり、その他の精神疾患罹患率が2-3倍になり、かつ糖尿病など身体疾患合併リスクも高まる
・心理療法としては認知行動療法、対人関係療法などの有効性が報告されている
・Dasotralineはドパミンおよびノルアドレナリントランスポーター阻害薬であり、半減期が長い(47-77時間)。(アトモキセチンはノルアドレナリントランスポータ阻害薬であり、ドパミントランスポータの阻害作用がほとんどない点で異なる)
・今回成人中等度から重度過食性障害に対するdasotralineの有効性と安全性を評価した
対象と方法
・18-55歳の過食性障害患者(DSM-5)。過去6か月間で平均1週間あたり2回以上の過食エピソード、最近2週間で3回/週以上の過食エピソードを有するもの
・これまで神経性無食欲症、神経性過食症の既往があるものは除外。精神病性障害、双極性障害、ADHDの既往、および最近6か月以内の中等度以上のうつ病の既往があるものは除外。最近12カ月以内の物質使用障害は除外。
・多施設無作為割付プラセボ対照比較試験
・Dasotralineは4mg、6mg、8mgの可変用量。
・主要評価項目は12週間での過食頻度(1週間あたりの日数)の変化(評価者が評価するものと加えて日記でも評価)。
・副次的評価項目はCGI-S、寛解率(最近4週間で過食エピソードがないものとして定義)、YBOCS-BEなど
結果
・Dasotraline群 N=155
・プラセボ群 N=160
・完遂率はdasotraline群 66.7%、プラセボ群 72.4%
・過食頻度の変化はdasotraline群 -3.74日/週、プラセボ群 -2.75日/週で有意差あり(効果量 0.74)
・CGI-Sにおいてもdasotraline群 -2.67点、プラセボ群 -1.53点で有意差あり(効果量 0.95)
・寛解率はdasotraline群 46.5%、プラセボ群 20.6%で有意差あり。YBOCS-BE特典も有意差あり(-17.05点対-9.88点)効果量 0.96
・10%以上に見られた副作用は不眠、口喝、食欲減退、不安、嘔気、体重減少、頭痛
・副作用による中断率はdasotraline群 11.5%、プラセボ群 2.5%
・Dasotraline群の5.1%が重度の不眠で中断
・Dasotraline群の5名で精神病症状がみられ(幻聴や妄想など)1名が中断に至った
結論
・数%に重大な副作用(不眠、精神病症状)が起こりうるため注意を要するが、dasotralineは成人中等症以上の過食性障害に対して有効な可能性がある
・dasotralineはADHD治療薬としての承認を目指していたが、2018年にFDAより不承認となっている。現在過食性障害治療薬としての承認を申請中
引用文献
1)Susan L McElroy et al. J Clin Psychiatry. 2020 Sep 8;81(5):19m13068. doi: 10.4088/JCP.19m13068.
2)Bello NT, Yeomans BL. Expert Opin Drug Saf. 2018 Jan;17(1):17-23. doi: 10.1080/14740338.2018.1395854. Epub 2017 Oct 31. -
児童思春期に対する向精神薬の安全性について
2020年09月16日
・児童思春期に対する向精神薬の安全性についての報告(文献1)がでました。
・参考にすべき点もありますが、今回の報告の解析方法には問題もあり、結果の解釈について慎重にならないといけない部分もあります。
・それは主要評価尺度がプラセボに対して有意な副作用を認めた項目数となっている点です。
・Nが大きくなればプラセボとの差が小さな副作用でも有意差が出現しうるため、適応承認されていたり、規模の大きなRCTが行われた薬剤ほど有意差が出やすい傾向があります。
・異なるメタ解析間の比較をしているため、ある薬剤では有意差がでやすく、一方でまた別の薬剤では有意差がでにくいということが起こりえます。
・なので参考にするならば児童思春期に対して適応承認されている薬剤で副作用がどのようになっているかのだいたいの傾向をみるくらいの見方をすることが望ましいことになります。その他の薬剤については結果の解釈に注意する必要があります。
・各薬剤の副作用ごとにNを抽出しようと思いましたが、論文中の表にはネットワークメタ解析が使用された項目については、すべての薬剤をひっくるめたNが記載されており、薬剤毎のNを求めるにはさらに元論文をあたる必要があり、大変な手間がかかるため断念しています。専攻医の皆さんは少し批判的にこの論文を吟味してみてください。
児童思春期精神疾患における80種類の向精神薬について78の副作用に関する系統的メタレビュー
背景
・早期介入とDUI(duration of untreated illness)短縮の観点から児童思春期の精神疾患に対して向精神薬が投与される機会があり、実際に適応承認されている薬剤もあるが、その安全性について比較された文献は少ない。そこで今回、80の向精神薬の78の副作用に関して系統的メタレビューを行った。
・解析の対象となったのはネットワークメタ解析、メタ解析のみならず、リアルワールドでの結果を反映するためコホート研究も含まれた(メタ解析の解析対象の大部分がRCTであり、RCTにおいては対象となる患者層が厳格に選出されており、小規模であったり、さらに試験期間も短期間であるものが多いため、結論を一般化することが困難であったり、長期間投与後に出現しうる副作用や、まれで重篤な副作用がもれてしまう可能性があるため)
方法と対象
・78の副作用は19のカテゴリーに分類された。以下の通り
1)中枢神経系(焦燥性興奮、不安、無力症、イライラ感、認知機能障害、うつ症状、浮動性めまい、頭痛、躁症状、精神病症状、鎮静、不眠、けいれん、希死念慮/自殺関連行動/自殺企図)。
2)栄養および代謝(食思不振、むちゃ食い/食欲亢進、コレステロール増加、中性脂肪増加、メタボリックシンドローム、耐糖能異常/糖尿病、インスリン抵抗性、腹囲長の増加、体重増加/BMIの増加、体重減少)
3)循環器系(不整脈/頻脈、心筋症、脳血管疾患、冠動脈疾患、高血圧、低血圧、心筋炎、QT延長、心臓突然死)
4)消化器系(腹痛、便秘、下痢、消化器症状、肝障害、悪心・嘔吐)
5)生殖器系(夜尿、腎臓病/腎不全、月経周期変化、多嚢胞性卵巣症候群、性機能障害)
6)運動器系(アカシジア、錐体外路系副作用、振戦、ジストニア、遅発性ジスキネジア)
7)衝動制御障害および危険な行動(犯罪行為、ギャンブル、物質乱用、自殺でない自傷行為)
8)内分泌系(女性化乳房/乳汁漏出症、低/高プロラクチン血症、甲状腺機能低下/甲状腺機能亢進症)
9)血液系(貧血、白血球減少症、血小板減少症)
10)口腔系(う蝕、ドライマウス、唾液分泌過多)
11)呼吸器系(急性呼吸不全、喘息、鼻咽頭炎・上気道感染症/肺炎)
12)静脈血栓塞栓症(深部静脈血栓症、肺塞栓症)
13)骨系(骨減少症/骨粗鬆症、骨折)
14)事故(あらゆる事故、転倒)
15)悪性症候群(悪性症候群/発熱/CK上昇)
16)あらゆる癌
17)有害事象による中止
18)重篤な有害事象
19)死亡(あらゆる理由による死亡、自然死によるもの、自殺による死亡)。
・向精神薬は4つのカテゴリーに分類
1)抗うつ薬
2)抗精神病薬
3)ADHD治療薬
4)気分安定薬
・主要評価項目は安全性/副作用項目数比=(プラセボと比較して有意に多かった副作用の項目数)/(全副作用項目数)。全副作用項目数は79の副作用分類のうち、各薬剤で報告されている副作用の数(ただし、79の副作用のうち20%以上(16個以上)の副作用について報告されている薬剤が解析対象となった)
・9つのネットワークメタ解析、39のメタ解析、90のRCTs,8つのコホート研究(N=120637(抗うつ薬)、N=66764(抗精神病薬)、N=148664(ADHD治療薬)、N=1621(気分安定薬))が解析対象となった
結果
抗うつ薬
・抗うつ薬のうち、16項目以上の副作用について記載のあった薬物は
1:エスシタロプラム(安全性/副作用項目数比=1/17:プラセボと有意差のあった項目:体重増加 OR 2.3(CI 1.01-5.25))
2:フルオキセチン(1/16:プラセボと有意差のあった項目:体重減少 MD -1.2kg(CI -1.85 -0.55))
3:ビラゾドン(2/16:プラセボと有意差のあった項目:副作用による中断 OR 8.55 (CI 1.13-64.8)、嘔気/嘔吐 OR 4.40 (CI 2.43-9.76))
4:パロキセチン(3/16:プラセボと有意差のあった項目:あらゆる錐体外路系副作用 OR 5.12(CI 1.09-24.1)、不眠 OR 4.05(CI 1.94-8.49)、嘔気/嘔吐 OR 3.69 (CI 1.01-13.5))
5:セルトラリン(4/19:プラセボと有意差のあった項目:下痢 OR 3.04(CI 1.25-7.38)、不眠 OR 4.05(CI 1.94-8.49)、嘔気/嘔吐 OR 2.65 (CI 1.03-6.77))、体重増加)
6:ベンラファキシン(7/16:プラセボと有意差のあった項目:腹痛 OR 2.36(CI 1.29-4.32)、食思不振 OR 4.25(CI 1.55-11.63)、副作用による中断 OR 3.19 (CI 1.01-18.70)、頭痛 OR 0.56(CI 0.35-0.92)、高血圧、重篤な有害事象 OR 4.14 (CI 1.15-14.9)、希死念慮ないし自殺関連行動 OR 0.13 (0.00-0.55)→有意な増加)
・参考としてデュロキセチン(3/13:プラセボと有意差のあった項目:下痢、副作用による中断、嘔気/嘔吐)・エスシタロプラムは12歳以上の大うつ病にFDAより適応承認
・フルオキセチンは7歳以上のOCD、8歳以上の大うつ病にFDAより適応承認
抗精神病薬・抗精神病薬のうち、16項目以上の副作用について記載のあった薬物は
1:ルラシドン(安全性/副作用項目数比=1/33:プラセボと有意差のあった項目:嘔気/嘔吐 OR 3.1 CI 1.50-6.60)
2:アセナピン(2/22:プラセボと有意差のあった項目:BMI増加、血糖値増加)
3:クエチアピン(5/37:プラセボと有意差のあった項目:コレステロール増加 MD 10.8(CI 6.6-14.5)、高プロラクチン血症 SMD 0.4(CI 0.1-0.7)、鎮静 OR 5.40 (CI 2.90-9.30)、中性脂肪増加 MD 19.5(CI 11.8-27.2)、体重増加 OR 6.20 (CI 2.60-13.6))
4:ジプラシドン(4/25:プラセボと有意差のあった項目:あらゆる錐体外路症状 OR 20.6(CI 3.50-69.0)、浮動性めまい OR 9.15 (CI 1.20-69.7)、嘔気/嘔吐 OR 4.80(CI 1.10-21.1)、鎮静 OR 8.70 (CI 2.70-22.0))
5:パリペリドン(5/26:プラセボと有意差のあった項目:アカシジア OR 5.60 (CI 1.80-17.7)、あらゆる錐体外路系副作用 OR 6.30 (CI 2.30-16.8)、高プロラクチン血症 SMD 0.61(CI 0.35-0.86)、鎮静 Log OR -2.4(CI -4.4 - -0.3)、体重増加 SMD -0.7(CI -1.0 - -0.5))
6:リスペリドン(12/44:プラセボと有意差のあった項目:アカシジア OR 4.0(CI 1.40-10.9)、あらゆる錐体外路症状 OR 3.70(CI 2.20-6.0)、脱力感 OR 3.89 (CI 1.77-8.53)、便秘 OR 3.42 (CI 1.33-8.80)、消化器症状 OR 3.74 (CI 1.15-12.2)、血糖値増加 MD 3.70(CI 1.10-6.40)、高プロラクチン血症 OR 38.6(CI 8.60-126)、食欲増加 OR 4.82 (CI 2.35-9.88)、上気道感染症 OR 3.14(CI 1.26-7.80)、鎮静 OR 7.30(CI 4.60-11.2)、頻脈 OR 6.87(CI 1.49-31.7)、体重増加 OR 6.0 (CI 3.0-11.0))
7:アリピプラゾール(10/35:プラセボと有意差のあった項目:アカシジア OR 3.10 (CI 1.0-9.0)、あらゆる錐体外路症状 OR 3.80 (CI 2.20-6.20) NNH=4.1、脱力感 OR 8.54(CI 2.59-28.1)、食思不振 OR 5.11(CI 1.14-23.0)、コレステロール増加 RR 2.50(CI 1.40-4.40)、発熱 OR 5.89(CI 1.23-28.2)、鎮静 OR 6.10 (CI 2.80-12.2)、唾液分泌過多 OR 10.5 (CI 1.30-84.2)、振戦 OR 11.5 (CI 1.40-91.6)、体重増加 OR 4.40 (CI 2.0-8.90)):多くが自閉スペクトラム症に対する試験結果から得られたもの
8:オランザピン(13/25:プラセボと有意差のあった項目:アカシジア OR 3.70(CI1.10-12.7)、貧血、あらゆる錐体外路系副作用 OR 6.40 (CI 2.40-13.8)、コレステロール増加 MD 4.5 (CI 1.2-7.7)、CK上昇、血糖値上昇 MD 2.1(CI 0.1-4.3)、高プロラクチン血症 OR 15.6 (CI 4.40-41.1)、高血圧、肝機能障害 OR 18.7 (CI 3.60-96.4)、性機能障害 MD 11.5(CI 8.80-14.1)、鎮静 OR 8.50(CI 4.0-16.6)、中性脂肪増加 OR 5.10 (CI 2.80-9.40)、体重増加 OR 15.1(CI 6.60-31.1))
コメント
・FDAより自閉スペクトラム症に対して適応承認の得られているアリピプラゾール(6-17歳)、リスペリドン(5-16歳)についてはデータが多く、副作用に着目したネットワークメタ解析も行われており、それ故に抽出された項目数が多いと思われます。
・オランザピンはFDAより思春期(13歳以上)の統合失調症、双極性障害に承認されており、この点でNが多く副作用項目も多くなっているのかもしれません。
・ただしTEA試験(文献5)のように思春期精神病患者に対する抗精神病薬投与により非常に高い割合で副作用がみられたという報告もあるため、児童思春期に対する抗精神病薬投与についてはかなり慎重になるべきということになります。
ADHD治療薬
・ADHD治療薬のうち、16項目以上の副作用について記載のあった薬物は
1:メチルフェニデート(安全性/副作用項目数比=5/25:プラセボと有意差のあった項目:腹痛 RR 1.50(CI 1.26-1.79)、食思不振 RR 3.21 (CI 2.61-3.94)、不眠 OR 4.66(CI 1.99-10.9)、嘔気/嘔吐 RR 1.38 (CI 1.04-1.84)、体重減少 SMD -0.77(CI -1.09- -0.45))
2:グアンファシン(4/16:プラセボと有意差のあった項目:腹痛 OR 4.51 (CI 1.34-15.2)、副作用による中断 OR 2.64(CI 1.20-5.81)、QT延長 Hedge's g=0.33 (CI 0.12-0.54)、鎮静 RR 2.43(CI 1.06-5.58))
3:アトモキセチン(5/20:プラセボと有意差のあった項目:食思不振 RR 2.51(CI 1.77-3.57)、消化器症状 RR 1.76(CI 1.51-2.07)、高血圧 SMD 0.12(CI 0.02-0.22)、嘔気/嘔吐 RR 1.91(CI 1.24-2.94)、体重減少 SMD -0.84(CI -1.16- -0.52))
気分安定薬・気分安定薬のうち、16項目以上の副作用について記載のあった薬物は
1:リチウム(安全性/副作用項目数比=0/16)
2:バルプロ酸(4/19:プラセボと有意差のあった項目:白血球減少、鎮静 NNH 7.8(CI 5.3-15.0)、血小板減少症、体重増加 効果量 0.4(CI 0.04-0.73))
コメント
・冒頭で述べたようにプラセボとの有意差の有無で副作用項目を抽出しているため、児童思春期の精神疾患に適応症を有する薬剤はNが多くなり、それゆえに有意差が出やすくなり、抽出される項目数が多くなる傾向があるため、項目数の大小のみで安全性を評価することはできません。・そのため今回の報告の結果を薬剤毎の比較に用いることはできません。
・抗うつ薬における希死念慮ないし自殺関連行動の増悪についてはベンラファキシンのみが有意であり、この結果は2016年のlancet誌に掲載されたネットワークメタ解析の結果を反映したものです。
・この報告ではパロキセチン、セルトラリンなどの抗うつ薬については、自殺関連行動ないし希死念慮の増悪傾向がみられましたが、統計的有意差はありませんでした。
・同様の結果は2012年のコクランレビュー(文献3)でも報告されていますが、この報告内において自殺関連事象の対プラセボの相対リスクが1を切る(プラセボより少ない傾向がある)抗うつ薬はエスシタロプラムとミルタザピンでした(ただし有意差はなし。ミルタザピンについては有効性についても有意差なし)。
・一方で自殺関連事象についてはpublication biasにより正しく論文に反映されていない(過少に報告されている可能性)のではないかということを指摘する報告(文献4)もあり、論文中の結果をうのみにしてはいけないのかもしれません。
引用文献
1)Marco Solmi et al., World Psychiatry. 2020 Jun;19(2):214-232. doi: 10.1002/wps.20765.
2)Cipriani A, Zhou X, Del Giovane C et al. Lancet 2016;388:881-90.
3)Cochrane Database Syst Rev. 2012 Nov 14;11:CD004851. doi: 10.1002/14651858.CD004851.pub3
4)BMJ. 2014 Jun 4;348:g3510. doi: 10.1136/bmj.g3510.
5)Lancet Psychiatry. 2017 Aug;4(8):605-618 -
認知症のリスク因子について
2020年09月10日
3年ぶりに認知症の教科書ともいえる論文(文献1)が改訂となりました。認知症診療に携わる全ての臨床医がチェックすべき論文と思われます。
今回はその中から、今回認知症のリスク因子として抽出された12の因子について、まとめておきたいと思います。Dementia prevention, intervention, and care: 2020
サマリー
・若年死亡率の低下に伴い、認知症高齢者の数は増加している。しかし、教育、栄養、ヘルスケア、ライフスタイルの変化などの改善により、多くの国で認知症の年齢別発症率は低下している。
・2017年のLancet Commission on dementia prevention, intervention, and careでモデル化された認知症の9つの潜在的な危険因子である、教育不足、高血圧、聴覚障害、喫煙、肥満、うつ病、運動不足、糖尿病、社会的接触の少なさ、に加えて今回、認知症の危険因子をさらに3つ追加した。
・追加された因子は、過度のアルコール摂取、外傷性脳損傷(TBI)、大気汚染である。
・修正可能な12の危険因子を合わせると、世界の認知症発症の約40%に関与しており、理論的には認知症発症を予防または遅延させることが可能である。
・予防効果は認知症の発生が多い低所得国や中所得国(LMIC)ではより高い可能性がある。認知症予防のための介入は、ライフコースの中で早すぎることも遅すぎることもない
・教育不足が認知症リスクと関連するため、政策は、すべての人を対象とした児童教育の実施を優先すべきである。頭部外傷を最小限に抑え、有害な飲酒を減らすことで、若年発症の認知症や晩年発症の認知症を減らすことができる可能性がある。
・中年期の収縮期血圧管理は、認知症予防のため、130mmHg以下を目指すべきである。中年期後期になっても禁煙することで、リスクは軽減される。受動喫煙は認知症の危険因子としてはあまり考慮されていない。多くの国では、受動喫煙を制限している。
・特に大気汚染の多い地域では、大気汚染の改善を急ぐべきである。
・中年期以降も認知的、身体的、社会的に活動的であることを推奨する。
・補聴器の使用は、難聴による認知症リスクを減少させるようである。
・中年期から晩年にかけての持続的な運動は、肥満、糖尿病、心血管系のリスクを減少させることで認知症を予防すると考えられる。
・うつ病は認知症のリスクになるかもしれないが、晩年になると認知症がうつ病を引き起こす可能性がある。
・行動を変えることは難しく、純粋に因果関係があるとは限らないが、個人の行動変容が認知症リスクを減らす可能性は非常に大きい。
・低所得国や中所得国(LMIC)では、誰もが中等教育を受けられるわけではなく、高血圧、肥満、難聴の割合が高く、糖尿病や喫煙の有病率が上昇しているため、予防が可能な認知症の割合がさらに高くなっている。
・アミロイドβやタウなどのバイオマーカーはアルツハイマー型認知症への進行リスクと関連するが、これらのバイオマーカー陽性のみで認知が正常な人の大半は認知症を発症しない。
・認知症の人は多くの領域で複雑な問題や症状を抱えている。介入は個別化され、本人だけでなく介護者への介入も考慮すべきである。
・周辺症状を管理するために、患者のニーズに合わせて心理社会的介入を行うことは、少なくとも短期的には有効であるというエビデンスが蓄積されてきている。
・介護者に対するエビデンスに基づいた介入は、何年にもわたって抑うつや不安症状を軽減し、費用対効果も高い。
・認知症患者は同年代の人に比べて身体的な健康問題を抱えているが、地域の医療ケアを受けることが少なく、ケアへのアクセスやケアの組織化が困難であることが多い。認知症患者は他の高齢者に比べて入院が多く、その中には自宅で管理しうる病気も含まれている。COVID-19の流行では、認知症患者は死亡率は相対的に高かった。
・認知症の予防、介入、ケアのために早急に行動を起こすことは、認知症患者とその家族、ひいては社会全体の生と死の問題を大きく改善することになる。
12のリスク因子について
教育および中年期、高齢期の認知刺激の効果
・小児期の高い教育レベルと高い生涯学習達成度は認知症リスクを減少させる・20歳以降プラトーに達するまでの教育により全般的な認知機能は増加することが示されている。小児期に認知面での刺激を与え、認知的キャパシティーを増加させることが重要であることを示唆するものである
認知機能を維持することと認知症リスク
・中国での大規模研究では、教育レベルが高い人が成人期での認知的活動が高くなるとの可能性を除外するため、教育レベルが異なる場合でも共通して行われると考えられる認知的活動(読書、ゲーム、賭博)を考慮して認知症リスクとの関連を調べた
・その結果、65歳以上でより頻繁に読書やゲームや賭博をする人は、認知症リスクが少ないことがわかった(OR=0.7 CI 0.6-0.8、N=15882)
・この結果は別の小規模研究の結果とも一致している。30-64歳の205名が66-88歳までフォローアップされ、教育レベルや職業、現在の脳器質的健康度によらず、旅行や社会的活動、楽器の演奏、芸術、運動、読書、第2言語を話すなどの活動が活発な人は、認知機能が保持されやすいことと関連した
認知機能の低下と認知的活動との関連
・認知的に要求の高い仕事に就いている人は、要求の低い仕事に就いている人に比べて、退職前、時には退職後に認知機能の低下が少ない傾向がある
・1658人を対象とした12年間の研究では、勤務年数ではなく退職年齢の高齢化が認知症リスクの低下と関連していることを報告している
・別の研究では、健康、年齢、性別、経済力を調整後に、非退職者と比較して、退職者はエピソード性記憶の喪失が2倍に増加していることを報告している(n=18575、平均年齢66歳)。
・同様に、平均年齢61歳で退職した3433人を対象とした研究では、言語記憶は退職前よりも退職後において38%(95%CI22~60)早く低下した。
健常者およびMCIに対する認知的介入の効果
・認知的介入は全般的ないし特定の領域の認知面の改善のための介入戦略ないしスキルからなる
・一般人口を対象にした3つのシステマティックレビューによると、コンピューターによる認知トレーニングを含む特定の認知介入による全般的な認知面での改善が得られるとのエビデンスは存在しない。ただしトレーニングを行った領域については改善が得られるかもしれない
・MCIに対する少なくとも4時間以上のコンピューターによる認知トレーニング(N=351、対照群 N=335)の17の介入試験のメタ解析によると、全般的認知機能の中等度の改善効果(Hedge’s g=0.4 CI 0.2-0.5)を認めた。しかし、質の高い研究は少なく、認知症の予防に関する長期的な質の高いエビデンスは現在のところ存在しない。
・MCIに対するコンピュータによる多様な介入についての30の試験のメタ解析はADLへの効果(d=0.23)およびメタ認知的効果(d=0.30)を対照群と比較して認めた
・MCIに対する5つの高品質試験(4つが集団対象、1つはコンピュータを用いたもの)についてのシステマティックレビューでは、MCIに対する認知トレーニングの効果については、結論を導くには不十分であると結論付けている
・健常高齢者、MCI、認知症に対する認知トレーニングについてのメタ解析の高品質な系統的総説では、大半の試験が低品質であり、positiveな結果を報告しているが、試験の質が低く、結果も多様であることから、結果が臨床的に意義のあるものかどうかわからないと結論付けている
・健忘型MCIを対象とした行動活性化(認知、運動、社会的活動の活性化)についての1つの介入試験(N=221)の結果は、支持的介入(attention control)と比較して、2年間での記憶機能の低下(Hopkins Verbal Learning Test-Revisedの総得点で6単語以上の記銘力の低下で定義)は行動活性化群1.2%、対照群9.3%で有意に認知機能の低下を防ぐ効果を認めるとの結果であった。同時に日常生活機能などについても有意に保持される結果となった。
聴覚障害
・聴覚障害は2017年の報告では最も高いPAF(population attributable fraction:認知症発症の何%を占めるか)を示し、聴覚障害は9-17年間のフォローアップ期間において、認知症発症の相対リスクが1.9と報告された。
・その後の同じ3つの前向き研究を用いたメタ解析によると、聴覚障害が10dB悪化する毎に、認知症発症のオッズ比が1.3(CI 1.0-1.6)ずつ増加することが報告されている。
・小規模のアメリカでの194名を対象とした前向きコホート研究では(ベースラインで平均54.5歳)、平均19年間のフォローアップにおいて、中年期での聴力障害は、海馬や嗅内皮質を含む急速な側頭葉体積の減少と関連したことが報告されてる
補聴器の使用
・65歳以上の3777名を対象とした25年間の前向き研究において、補聴器を使用している人を除き、自己申告による難聴者で認知症の発症率が増加することが明らかになった。
・50歳以上の高齢者2040人を対象としたアメリカの調査では、2年ごとに18年間にわたって検査を行った結果、補聴器の使用開始後、即時想起と遅延再生の低下が、他の危険因子を調整しても少なくなることが報告された。
・補聴器の使用は、その他の因子について調整後、認知機能低下に対する最も大きな保護的因子である。
・長角障害は認知刺激の減少により認知機能の低下をもたらす可能性がある。
頭部外傷
・ICDは軽症頭部外傷を脳振盪とし、重症頭部外傷を頭蓋骨骨折、脳浮腫、脳挫傷、脳出血と定義している。単回の重症頭部外傷はヒトないし動物モデルにおいて過剰リン酸化タウの広範な病態と関連することが報告されている。
・50歳以上の約300万人が平均10年間フォローされたデンマークのコホート研究において、頭部外傷は認知症リスク(HR 1.2 CI 1.2-1.3)、アルツハイマー型認知症リスク(HR 1.2 CI 1.1-1.2)と関連した。認知症リスクは頭部外傷後6か月間で最も高く(HR 4.1 CI 3.8-4.3)、頭部外傷の回数に応じて増加した(1回の頭部外傷 HR 1.2 CI 1.2-1.3、5回以上の頭部外傷 HR 2.8 CI 2.1-3.8)。
・50歳以上のスウェーデンのコホート研究においても、頭部外傷は1年間の認知症リスクを増加(OR 3.5 CI 3.2-3.8)され、30年間での認知症リスクも増加させた(OR 1.3 CI 1.1-1.4)
・軽症の単回頭部外傷も認知症リスクを増加(OR 1.6 CI 1.6-1.7)させ、より重症の頭部外傷(OR 2.1 CI 2.0-2.2)、複数回の頭部外傷(OR 2.8 CI 2.5-3.2)などと報告された
・178779名の頭部外傷歴のある退役軍人と、性質をマッチさせた頭部外傷歴のない退役軍人との比較において、意識消失のない軽症頭部外傷歴(HR 2.4 CI 2.1-2.7)、意識消失を伴う軽症頭部外傷歴(HR 2.5 CI 2.3-2.8)、中等度以上の頭部外傷歴(HR 3.8 CI 3.6-3.9)などと報告された
・28815名の脳振盪歴のある高齢者を3.9年フォローアップしたコホート研究では、認知症リスクが2倍となり、6名に1名の割合で認知症を発症した(スタチン内服は13%認知症リスクの低下をもたらした)
高血圧
・中年期の持続性の高血圧は晩年の認知症リスクと関連する
・Framingham Offspringコホートでは、収縮期血圧が中年期(平均55歳)で140mmHg以上の1440名が対象となり、18年以上追跡された結果、認知症発症リスクがHR 1.6(CI 1.1-2.4)と増加することが報告された。さらに平均69歳の晩期まで高血圧が持続すると、さらにリスクが上昇(HR 2.0 CI 1.3-3.1)となることが報告された
・後期中年期(平均62歳)における理想的な心血管系パラメータ(現在の非喫煙、BMI 18.5-25、定期的な運動、健康的な食生活、至適血圧(<120/<80mmHg)、コレステロール正常、空腹時血糖正常)を有する人が、これらのリスク因子を少なくとも1つ以上有する対照群と比較された結果、10年間のあらゆる認知症のリスク(HR 0.8 CI 0.1-1.0)、血管性認知症リスク(HR 0.5 CI 0.3-0.8)、アルツハイマー型認知症リスク(HR 0.8 CI 0.6-1.0)の低下と関連した。
・イギリスでの8639名の公務員を対象としたコホート研究において、50歳時点(60歳ないし70歳ではあてはまらず)での収縮期血圧130mmHg以上であることは、認知症リスクの増加(HR 1.4 CI 1.1-1.7)と関連した。45歳から61歳までの間で持続的に収縮期血圧130mmHg以上の群は、心血管疾患がなくても認知症リスクが高血圧がない群と比較してHR 1.3 CI 1.0-1.7と増大することが報告された
降圧薬、アスピリン、スタチンと認知症リスク
・50歳以上の高血圧症患者9361名を対象としたSPRINT試験は、収縮期血圧120mmHgを目指す積極的介入群(N=4678)において、対照群(標準治療群:収縮期血圧140mmHg未満を目指す N=4683)と比較して心血管系イベントや死亡が有意に少なかったため、試験は早期終了となった。認知機能のアセスメントはその後も継続され、介入終了後2年間において、積極的介入群の認知症リスクは標準ケア群と比較してHR0.8(CI 0.7-1.0)と減少を示した。MCIについてもHR 0.8(CI 0.7-1.0)と減少
・降圧剤投与と認知症リスクについての4つのメタ解析について、すべてのメタ解析において、あらゆる認知症リスクおよびアルツハイマー型認知症リスクの低下を報告している。
・最初の報告では、あらゆる降圧薬についてのRCTが解析対象となり、降圧薬投与はRR 0.9 CI 0.9-1.0とマージナルな有意差を示した。2つ目の報告では、利尿薬についての15の試験と観察研究が対象(N=52599、中央値76歳)となり、平均6.1年間の追跡期間において、認知症リスク(HR 0.8 CI 0.9-0.9)、アルツハイマー型認知症リスク(HR 0.8 CI 0.7-0.9)の減少を報告した。3つ目の報告では、6つの観察研究が対象となり認知症リスク(HR 0.9 CI 0.8-1.0)、アルツハイマー型認知症リスク(HR 0.8 CI 0.7-1.0)と報告されている。4つ目の報告では、Caブロッカーのみが解析対象となり、10 RCTsと観察研究が対象となり(N=75239、中央値 72歳)、フォローアップ期間中央値8.2年において、認知症リスクの低下(RR 0.7 CI 0.6-0.9)が報告された
・2019年のメタ解析では、どのクラスの降圧薬が認知症リスクの低下と関連するかが検討され、薬剤のクラス間の差はないとの結論であった
・コクランレビューでは、血管性疾患リスクのある高齢者へのスタチン投与は認知機能低下や認知症リスクを減少させることはないとの結論であった。
・100mgのアスピリンをプラセボと比較した1つの介入試験(65歳以上の健常者19114名の対象)の結果、アスピリンは認知症リスク(HR 1.0 CI 0.8-1.2)、死亡、運動機能障害、心血管系疾患のリスクを4.7年以上の追跡期間において、減少させることはないとの結論であった
運動不足とリスク、運動とフィットネスの認知症予防効果
・運動についての研究は複雑であり、運動の種類が多く、年齢と共に活動度が変化するなどの問題がある
・1-21年までの観察研究のメタ解析では、運動は認知症リスクの減少と関連することを報告している
・30-60歳までの28916名を対象としたHUNT試験によると、中年期の少なくとも週に1回の中等度から強度の運動が25年以上のフォローアップにおいて認知症リスクの減少と関連(HR 0.8 CI 0.6-1.1)する可能性が報告された
・10308名を対象に28年フォローアップされたWhitehall試験では、中等度から強度の週に2.5時間以上の運動は、10年以上の間の認知症リスクの低下と関連したが、28年間でのリスクの低下とは関連しなかった
・191名の平均50歳の女性を対象とした44年間の観察研究があり、ベースラインでの運動量が少ない群の32%、中等度の群の25%、強度の群の5%が認知症を発症した(強度対中等度 HR 0.1 CI 0.03-0.5)
・19の観察研究のindividual levelメタ解析により(N=404840、ベースライン年齢平均 45.5歳、平均フォローアップ期間14.9年)、診断前の10年間で運動不足な人は、あらゆる認知症リスク(HR 1.4 CI 1.2-1.7)、アルツハイマー型認知症リスク(HR 1.4 CI 1.1-1.7)とリスクが増加することが報告されたが、認知症になって運動量が低下する可能性を考慮し、診断前の10-15年間の運動不足と認知症リスクについて調べたところHR1.01(CI 0.89-1.14)と有意差は消失し(不活発はDMリスク HR 1.42、冠動脈疾患リスク HR 1.24、脳卒中 1.16とは有意に関連)、結論として運動不足は認知症リスクとは関連しないということとなった。(元となったBMJの論文では運動不足と認知症リスクは無関係との結論ですが、このlancet論文では発症前10年間の結果を引用しどちらかというと関係がありそうな書き方になっています)
・運動の認知症予防効果については、3つの質の高いメタ解析が報告されている。1番目は、50歳以上の認知的に正常な成人を対象(39RCTs)に、1回あたり45~60分持続する任意の頻度の中等度から強度の運動の効果を調べたもの。この解析では、1回45-60分の中等度または高強度の抵抗運動(13研究)または有酸素運動(18研究)について、全体的な認知機能の改善(SMD=0-3、CI 0-2-0-4)が報告されたが、ヨガについては両群の間に差はなかった。・MCIを対象としたRCTのメタ解析では、介入群(0-3、0-1-0-5)で全体的な認知能力が向上し、有酸素運動の効果はより高い(0-6、0-5-0-6)ことが報告されている。
・長期の運動に関するRCTの第3のメタ分析では、5つの研究(4つが12ヵ月、1つが24ヵ月)で、ベースラインの認知が正常な2878人が対象となった。認知症発症率は運動群で3.7%、対照群で6.1%でRR 0.6(CI 0.3-1.1)であり有意差は示されなかったがNが少ないためと考察された。
・2017年以降、WHOのガイドラインが発表されており、具体的な活動レベルが提示されている
・認知症リスクに対する筋力トレーニングなどの特定の種類の運動の効果に関するエビデンスは乏しい。
糖尿病
・230万人の2型糖尿病患者を含む14のコホート研究では102174名の認知症発症を含み、糖尿病は認知症の相対リスク女性1.6(CI 1.5-1.80)、男性1.6(CI 1.4-1.8)t報告された。認知症リスクは糖尿病の罹病期間と重症度に伴い増加した。
・どの糖尿病治療薬が認知症リスク低減と関連するかについてはよくわかっていないが、1つのメタ解析においてメトフォルミンが有意に認知機能障害リスク低減と関連する(OR 0.6 CI 0.4-0.8)と報告された(3 studies)。また縦断的にその他の糖尿病治療薬ないし無投薬と比較して認知症発症率を有意に減少させる(HR 0.8 CI 0.4-0.9)(6 studies)と報告された。ただし、その他の報告ではメトフォルミンの優位性は支持されなかった。一方でインスリン療法の有害性の可能性(RR 1.2 CI 1.1-1.4)が報告された。
・2型糖尿病は認知症の明白なリスク因子であるが、どの薬剤がより良いかは不明確であり、認知症予防においてintensiveな治療が標準的治療を上回るとの根拠もない。
過剰なアルコール摂取
・フランスでの5年間の前向き研究では3100万人の入院患者が対象となり、アルコール使用障害は認知症リスクと関連することが報告された(女性HR 3.3 CI 3.3-3.4 男性 HR 3.4 CI 3.3-3.4)
・とりわけ65歳未満発症の若年性認知症においてアルコール使用障害との関連が明らかである。若年性認知症では56.6%がアルコール使用障害を有していたと報告されている
・45 studiesのシステマティックレビューでは、軽度から中等度までの飲酒は認知症リスクの減少と関連することを報告した(RR 0.7 CI 0.6-0.91)。1週間で21単位未満(1単位はアルコール10mlないし8gに相当)のアルコール摂取は認知症リスク低減と関連するかもしれない
・週21単位以上の飲酒と長期禁酒は、14単位未満の飲酒と比較して認知症リスクの17%の増加と関連した。また14単位以上の飲酒はMRI上右海馬の萎縮と関連していた。
体重コントロールと肥満
・35歳から65歳までの589649名を含む19の観察研究(最大42年追跡)のレビューにより、BMIが30以上は認知症相対リスクがRR 1.3(CI 1.1-1.6)であったが、BMI 25-30については有意なリスク増加と関連しなかった(RR 1.1 CI 1.0-1.2)。
・7 RCTs(N=468)と13の観察研究(N=551)の認知症のない肥満成人(平均50歳)を対象としたメタ解析によりBMI25以上の人が2kg以上の減量をすると有意な注意および記憶力の改善と関連することを報告した。
喫煙
・60歳以上の4年以上禁煙している50000名の男性を対象とした観察研究により、喫煙者と比較して、その後の8年間の認知症リスクが有意に減少することが報告された(HR 0.9 CI 0.7-1.0)
うつ病
・62,598人を対象とした32 studiesのメタ解析では、2年から17年の追跡期間で、抑うつエピソードは認知症の危険因子であることが示された(効果量 2.0、CI 1.7-2.3)。
・ノルウェーのHUNT研究では、心理的苦痛が25年後の認知症発症を予測することが示唆されたが、確実な結論ではない(HR1.3, CI 1.0-1.7)。イギリスのWhitehall研究では、10189人を追跡調査し、晩年にはうつ症状が認知症リスクを増加させるが、若年のうつ症状では増加しないと報告している(追跡調査11年HR 1.7; CI 1.2-2.4; 追跡調査22年HR 1.0, 0.7-1.4)。
・71-89歳の認知的に健康な男性4922人を対象とした14年間の縦断的研究では、うつ病は認知症の発症率の1.5倍(CI 1.2-2.0)の増加と関連したが、この関連性はうつ病発症後5年以内に認知症を発症した人によって説明されていた。
・抗うつ薬の使用はそのリスクを低下させなかった。抗うつ薬による治療が認知症リスクを軽減するかどうかという問題は、未解決である。
社会的接触
・社会的接触は認知症の予防因子として認められているが、認知症の進行に伴って孤立が起こる可能性がある。
・中年以降は結婚している人が多いが、高齢になると、一般に女性は男性よりも長命なため、未亡人となると社会的な接触が少なくなる。
・全世界の812047人を対象としたシステマティックレビューとメタ解析では、生涯独身者(RR1.4、CI1.1-1.9)と未亡人(1.2、1.0-1.4)は既婚者に比べて認知症リスクが高く、その関連性は異なる社会文化環境で一貫していた。
・社会的孤立と認知機能に関する51の縦断的コホート研究のシステマティックレビューとメタアナリシスでは、ベースライン時に50歳以上の102035人の参加者が含まれており、2~21年の追跡調査が行われ、高頻度の社会的接触は晩年の良好な認知機能と有意に関連し(r=0.05 CI 0.04-0.065)、性差は認めなかった
・新たなメタ解析では、長期研究(10年以上)において、良好な社会的交流が認知症リスクに対して軽度に保護的であることがわかった(n=8876, RR=0.9, CI 0.8-1.0)。孤独感は認知症リスクとの関連は有意ではなかった
・イギリスでの28年間の観察研究では、10308人が対象となり、60歳での社会的接触の頻度が高いほど、15年間の追跡期間で認知症リスクが低いことが報告された(1標準偏差の社会的接触頻度の増加によりHRは0.9、CI 0.8-1.0)
・日本の縦断的コホート研究では、65歳以上の成人13984人を対象に、平均10年間の追跡調査で、婚姻状況、家族との交流、友人との交流、コミュニティ集団への参加、仕事従事の有無の5段階評価の社会的接触尺度を算出した。その結果、最高得点の人は低得点の人に比べて46%認知症になる可能性が低く、得点は認知症リスクの低下と直線的に関連していることがわかった。
大気汚染
・動物実験では、空気中の粒子状汚染物質が、脳血管疾患や心血管疾患、Aβ沈着、アミロイド前駆蛋白質処理などを介して神経変性過程を加速させることを示唆する結果が得られている
・二酸化窒素(NO2)濃度が高いこと(>41-5 μg/m3; 調整後HR 1-2、CI 1.0-1.3)、交通機関の排気ガスからの微粒子状物質(PM2.5)(調整後HR 1.1、CI 1.0-1.2)、住宅用木材燃焼からのPM2.5(1 μg/m3増加でHR=1.6、CI 1.0-2.4)は、認知症発症率の増加と関連することが報告されている。
・大気汚染物質曝露と認知症発症の関連について1-15年追跡調査を行った13の縦断的研究の系統的レビューでは、PM2.5、NO2、一酸化炭素への曝露がすべて認知症リスクの増加と関連していることが報告された
コメント
定年延長の流れがありますが、認知症予防の観点からは望ましいことなのかもしれません。仕事を辞めて何もしないよりも、なんらかの生産的活動に従事するか、仕事を続ける方が認知症リスクは低いようです。年をとってからも身体や頭を使うような何かを持っておいた方が、心身共に健康度が高いといえそうです。引用文献
1)Lancet. 2020 Aug 8;396(10248):413-446. doi: 10.1016/S0140-6736(20)30367-6. Epub 2020 Jul 30. -
抗精神病薬の用量効果関係について
2020年08月29日
・抗精神病薬の薬剤毎の用量効果関係についてのメタ解析結果が文献1にて報告されています。この論文の結果は臨床医として知っておいた方が良いと思われます。・ただし、プラセボ対照試験のみを解析対象としているため、解析対象となった試験の数は少なく、エビデンスの質としてはそこまで確かなものではありません。
・固定用量の介入試験について、プラセボ対照ではないものについても、ネットワークメタ解析を行い、対プラセボの効果量を推定し解析に含むことは可能と思われるため、そのような解析を行ってみても面白いのかもしれません。
背景
・急性期統合失調症治療における抗精神病薬の用量効果関係はよくわかっていないが、臨床家にとって、最小有効用量と最大有効用量を知ることは重要である
・多くの薬剤では用量効果関係は横軸に用量の対数をとるとS字型曲線となることが知られている
・今回、抗精神病薬の用量効果関係についての臨床試験を基にメタ解析を行い、最大有効用量に近い用量(ED95)を決定するために定量的な解析を行った
・さらに、現在承認されている用量よりもさらに高用量を用いた臨床試験を行うべき薬剤がないかどうかについても検討した
最後に、最大有効用量の近似値(ED95)を用いて等価用量換算を行った対象と方法
・統合失調症ないし統合失調感情障害慢性期の急性増悪に対する、2種類以上の固定用量でのプラセボ対照介入試験
・さらに初発精神病、陰性症状主体群、高齢者、治療抵抗性とにわけて解析を行った
・症状変化はPANSSないしBPRSを使用(陰性症状主体の試験についてはPANSS negativeかSANSを使用)
・試験毎に用量効果関係を25パーセンタイル、50パーセンタイル、75パーセンタイルの3点に制御点を有するスプライン曲線で近似。その後各試験のスプライン曲線を多変量random-effects modelで統合
・ED50をプラセボと比較して最大効果の50%の症状改善効果が得られる平均用量と定義。ED95は最大効果の95%の症状改善効果が得られる平均用量。ED95を有効性に関する等価用量換算に使用
・解析に使用された試験の数は、アミスルプリド N=3、アリピプラゾール N=5、アリピプラゾールLAI N=1、アセナピン N=6、ブレクスピプラゾール N=4、カリプラジン N=4、クロザピン N=1、ハロペリドール N=1、イロペリドン N=4、ルラシドン N=7、オランザピン N=4、オランザピン LAI N=1、パリペリドン N=5、パリペリドンLAI N=4、クエチアピン N=4、リスペリドン N=4、リスペリドン LAI N=1、セルチンドール N=4、ジプラシドン N=5
・試験期間の中央値は6週間(4-26週)
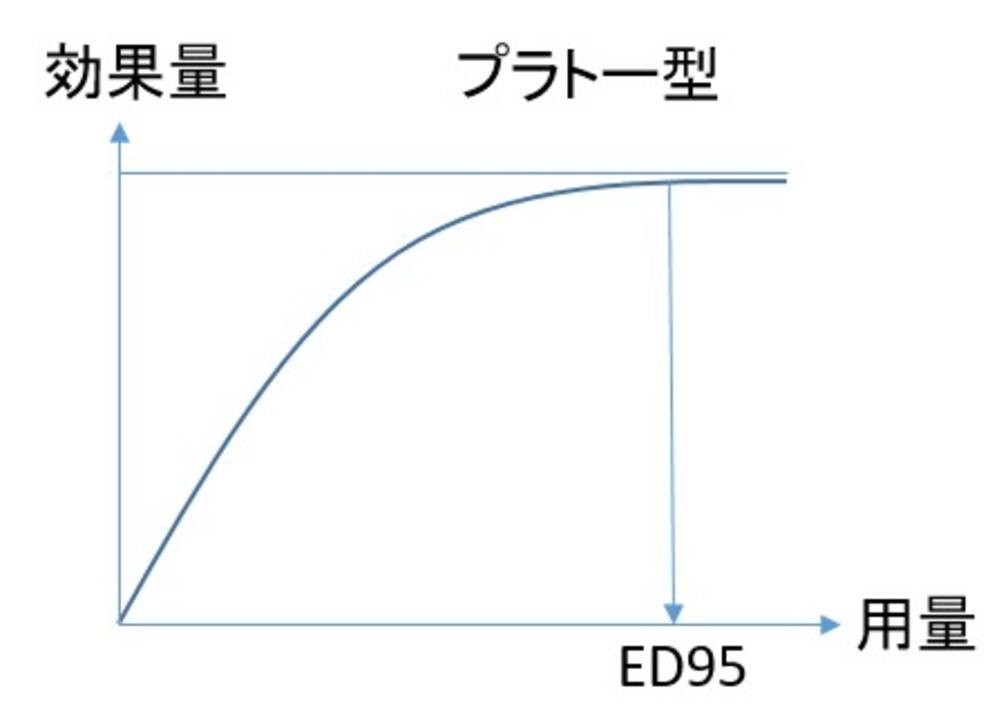
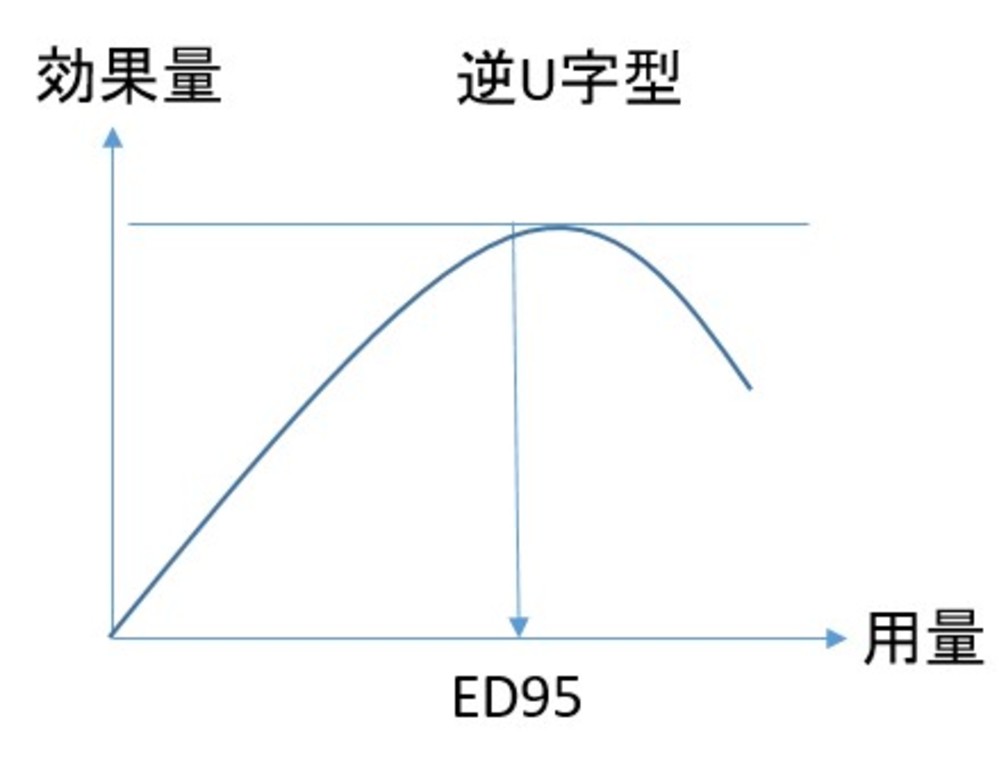
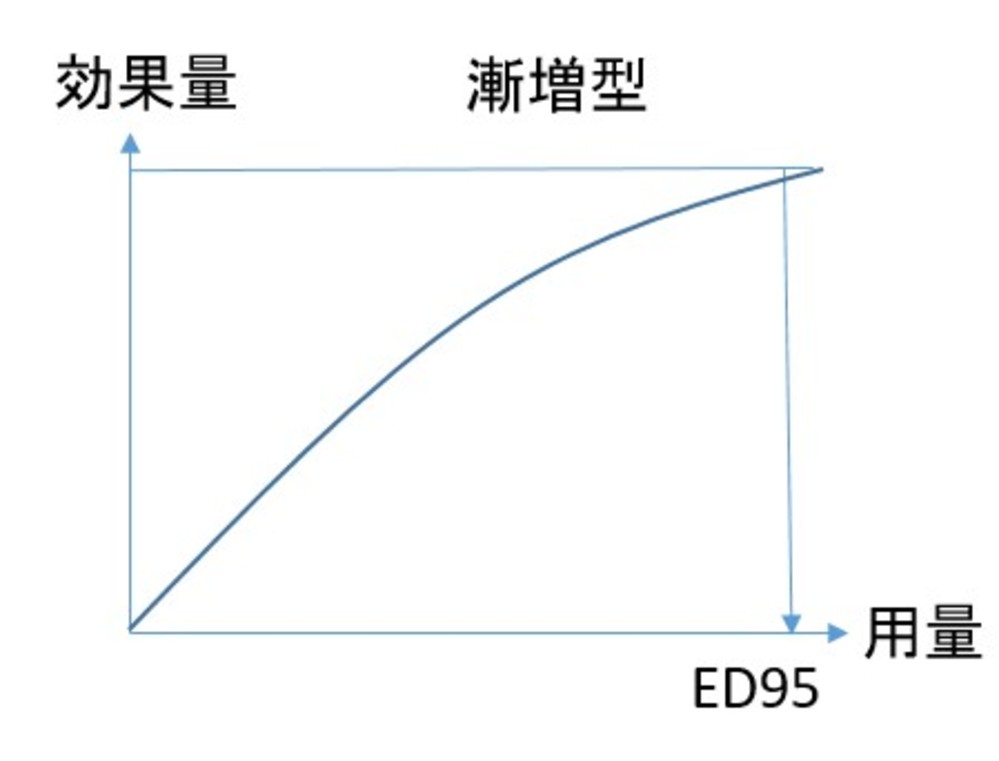
・用量効果関係を、プラトー型、逆U字型、漸増型に3分類(下図)
結果・陰性症状主体の患者に対するアミスルプリド:50-300mgの低用量アミスルプリドによる陰性症状主体の患者に対する2つの臨床試験から、ED95 は約70mg/dayであり、さらに、用量効果関係はプラトー型で、高用量でより有効性が増大することを示唆する結果は得られなかった
・陽性症状に対するアミスルプリド:陽性症状の急性増悪に対する1つの試験(100mgを400mg、800mg、1200mgと比較)の結果から、用量効果関係は逆U字型であり、537mg程度で効果が最大となることを示唆する結果となった
・経口アリピプラゾール:5つの急性期に対する固定用量試験(2-30mg)の結果からED95は約12mgであり、用量効果曲線はやや逆U字型に近く、高用量がより有効であることを示唆する結果は得られなかった
・アリピプラゾールLAI(lauroxil):1つの急性期に対する試験があり、441mgと882mgがプラセボと比較。プラトー型でありED95 は463mg
・アセナピン:急性期の6つの試験があり0.4mgから20mgを比較。ED95 は15mgであり、用量効果曲線はプラトー型であった
・ブレクスピプラゾール:4つの急性期試験があり、ED95が3.4mgであり、用量効果曲線はプラトー型であった
・クロザピン:治療抵抗性に対する小規模(N=48)試験があり、100mg、300mg、600mgが比較。クロザピンの固定用量での比較試験はこれのみ。ED95 は567mg。用量効果曲線は小規模にて推定困難(無理やり当てはめると漸増型)
・ハロペリドール:急性期に対する1つの固定用量試験があり、4mg、8mg、16mgが比較。用量効果曲線は逆U字型であり、ED95 は6.3mg
・ルラシドン:6つの急性期に対する固定用量試験があり、20mgから160mgまで比較。用量効果関係は漸増型であり、ED95 は147mg。さらに高用量で有効性の増大が期待できる可能性がある
・経口オランザピン:2つの急性期に対する固定用量試験があり、1mgから15mg±2.5mgまで比較。用量効果関係は漸増型であり、ED95は15.1mg。さらに高用量で有効性の増大が期待できる可能性がある結果となった
・経口オランザピン:陰性症状主体の患者に対する1つの固定用量試験があり(N=174)5mg、20mgがプラセボと比較。ED95 は6.5mgとなり、用量効果関係は逆U字型となった。2点しか観察点がないため一般化困難
・オランザピンLAI:1つの急性期に対する固定用量試験があり、210mg(2週に1回)、405mg(4週に1回)、300mg(2週に1回)が比較。405mgを203mg(2週に1回)に変換し比較。用量効果関係は漸増型だが、2点しか観察点がなく、一般化は困難
・経口パリペリドン:5つの急性期に対する固定用量試験があり、1.5mgから15mgが比較。ED95は13.4mgとなり、用量効果関係は漸増型となった
・パリペリドンLAI:4つの急性期に対する固定用量試験があり、25mgから150mgが比較。ED95は120mg。用量効果関係はプラトー型に近い漸増型
・クエチアピン:4つの急性期試験があり、75mgから800mgが比較。ED95は482mgであり、用量効果関係はプラトー型。速放製剤と徐放製剤とでわけて解析すると、速放製剤のED95は297mg、徐放製剤では739mgと大きな違いがあった(ただし徐放製剤の最小設定用量が300mgでありそれ以下の効果が不明)
・経口リスペリドン:3つの急性期試験があり、2mgから16mgまで比較。ED95 は6.3mg。用量効果関係は逆U字型
・リスペリドンLAI:1つの急性期試験があり、25mg(2週間に1回)、37.5mg、75mgを比較。ED95 は37mgであり、用量効果関係は逆U字型
・ED95の数値から、有効性についてリスペリドン1mgに対する等価用量換算を行うと、アリピプラゾールは1.84mg、アセナピン 2.39mg、ブレクスピプラゾール 0.54mg、ハロペリドール 1.01mg、ルラシドン 23.49mg、オランザピン 2.42mg、パリペリドン 2.13mg、クエチアピン 77.01mgなどとなった
・全体を平均するとリスペリドン換算で急性期においては3.66mgを超えたあたりで効果はプラトーに達する傾向がみら、それ以上の増量は有意な効果の増強はもたらさないとの結果となった
結論
・オランザピン、パリペリドン、ルラシドン、ジプラシドン、セルチンドール、イロペリドンについては、用量効果関係が、承認用量範囲内で漸増型を示し、さらに高用量において効果が増強する可能性を示唆する結果となった。ただし今回の解析は副作用を考慮しておらず、さらに高用量では有害性が有効性を上回る可能性があり、慎重な解釈を要する。
・個々の患者では代謝能力なども異なるため、個別の症例で用量を最適化することが望ましい
コメント
・以前より統合失調症に対する抗精神病薬の有効性についての用量効果関係は、D2受容体の占有率との関係から、あるところでピークに達し、それ以上は効果増大せず有害性が増大してくると言われていましたが、逆U字型の用量効果関係を示す薬剤があったり、一方で承認された用量の範囲内では効果は最大に達するようにみえず、さらにそれ以上の用量での効果の増大が見込める可能性がある薬剤があるなど、臨床上重要な知見が含まれている論文と思われました。今後さらに固定用量での試験結果が集積されて、結論が確かなものになっていくことが期待されます。
引用文献
1)Stefan Leucht et al. Am J Psychiatry. 2020 Apr 1;177(4):342-353.




