-
Muse細胞の話題とか
・ここ最近メディア上でもニュースになりましたが、岡山大学の研究チームがMuse細胞をSOD1変異ALSモデルマウスに移植して治療的効果がみられたことを10月13日付のScientific Reports誌に公表しました(Sci Rep. 2020 Oct 13;10(1):17102)。
・何が素晴らしいかというと、静注で中枢神経に到達しているところです。現在第3相試験が行われている自家間葉系幹細胞であるBrainstorm社のNurOwn細胞は髄腔内投与(くも膜下腔内投与)となっていますが、これはおそらく以前の当ブログでも触れたように静注すると肺にひっかかって、中枢神経まで到達しないからだと思われます。
・ですので、これまでの慣習では間葉系幹細胞については、腰椎穿刺をして、髄腔内カテーテルから注入というのが筋でした。
・Muse細胞は優れた遊走能を発揮して中枢神経に到達しているため、非侵襲的な幹細胞移植が可能となる可能性があり、期待がもてるものです。
・間葉系幹細胞といえば、10月19日付のNeurological Research誌に中国の研究グループが公表した論文(Neurol Res. 2020 Oct 19:1-11)に、ヒト臍帯間葉系幹細胞由来運動神経細胞(human umbilical cord mesenchymal stem cell-derived motor neurons)という文字があり、まじか、となりました。
・これも以前触れたことですが、中胚葉系といわれる間葉系幹細胞でも外胚葉系細胞に分化しうるということが報告されているわけですが、ここまで明示的に間葉系幹細胞由来の神経細胞という文字をみたことがなかったので衝撃でした。技術的背景は気になるところです。
・あと面白いなと思ったのは、フランスのソルボンヌ大学の研究グループが11月号のNature Neuroscience誌に掲載した、末梢のマクロファージを修飾すると、ミクログリアの活性に影響し、神経保護作用を発揮する形態に変化させうるという報告(Nat Neurosci. 2020 Nov;23(11):1339-1351.)でした。
・大学で元論文をゲットしようと思ったのですが、経費削減のためかNature Neuroscience誌にアクセス権がなく、どのようにマクロファージを修飾したのかよくわからなかったのが心残りですが、末梢の免疫系細胞を加工することで中枢神経の神経変性過程に影響を及ぼしうるというのはとても興味深い報告でした。
・あとは10月3日付のCell誌に掲載されたTDP-43蛋白症の病態機序についての報告も面白いものでした。TDP-43はミトコンドリアに侵入し、ミトコンドリアの透過性遷移孔を介したDNA放出を引き起こし、細胞質のDNAセンサーであるcGAS(cyclic guanosine monophosphate-AMP synthase)がそれを探知し、炎症反応を誘発するというものでした。cGASや、その下流経路の存在する物質を阻害するとNF-κBなどの炎症促進性サイトカイン産生が抑制されており、治療的観点からも注目すべきものと思われます。
-
エスシタロプラムは違うのか
2020年10月25日
・大うつ病に対するSSRIの用量効果関係についてはFurukawaらの報告(Lancet Psychiatry. 2019 Jul;6(7):601-609. )がよく知られているところです。つまりフルオキセチン換算20~40mg程度までは用量の増加に伴い効果も増加が見込める可能性があるものの、それ以上については効果が減弱する傾向がみられ、臨床用量の範囲内においても逆U字型の用量効果関係となる可能性があるというものです。
・しかしエスシタロプラムについては臨床用量の範囲(20mgまで)で、そのような関係性はみられないかもしれません。
・この報告以前から、SSRIの用量効果関係については、あるところでピークに達するとの報告が複数ありました。
・古いものからみてみると、フルボキサミンについてはWalczakらが (Ann Clin Psychiatry. 1996 Sep;8(3):139-51.)、フルボキサミンの最小有効用量が50mg(N=101)であり、100mg(N=100)が最も反応率が高く、150mg(N=99)では副作用が多く有効性も減少することを報告しています。
・フルボキサミンについては50mgで視床でのセロトニントランスポーターの占有率( [11C](+)McN565をリガンドとして使用:リガンドとしては[11C]DASBの方が特異性が高くS/N比が高いことから最近の主流となっている )が80%を超えるとの報告があり( Arch Gen Psychiatry. 2003;60(4):386-391)そのことと臨床効果がある程度相関しているのかもしれません。
・セルトラリンについては、2001年にSchweizerら(Int Clin Psychopharmacol. 2001 May;16(3):137-43.)が3週間オープンでセルトラリン50mgを投与し、寛解基準(HAM-D17で8点以下)を満たさない場合にセルトラリン50mg継続継続群(N=37)と150mg増量群(N=38)に無作為割付してその後5週間追跡し非寛解率を比較しました。
・その結果、非寛解率に両群間有意差はなく、高用量で恩恵をうける患者の存在を否定するものではないものの、用量増大による効果増強について懐疑的な結果となりました。
・セルトラリンについては最近ではSUN D試験(Kato et al. BMC Med. 2018 Jul 11;16(1):103.)において、治療歴のない大うつ病患者について、3週間のセルトラリン50mgないし100mgの無作為割付比較試験が行われ、その後各群継続(寛解後継続と非寛解後継続)ないしミルタザピン併用ないしミルタザピン置換の8群間比較試験が行われました。
・セルトラリン50mg(N=390)と100mg(N=391)との比較だけに注目すると、投与開始9週時点での反応率は両群間有意差なく、全体として100mgまで増量することの治療効果の差は見いだされませんでした。
・セルトラリンによるセロトニントランスポーターの占有率については約50mgの4週間投与で線条体においては80%を超える(リガンドとして[11C]DASBを使用)との報告(Am J Psychiatry. 2004 May;161(5):826-35. )があり、このことが用量効果関係を説明しうるのかもしれません。
・パロキセチンについてはRuheらの報告(Neuropsychopharmacology. 2009 Mar;34(4):999-1010.)によると6週間オープン試験でパロキセチン20mgが投与され、その後非反応群が20mg継続群(N=30)と30-50mgまでの増量群(N=30)に無作為割付され、さらに6週間比較されました。
・その結果反応率は継続群33.3%対増量群37%で有意差はありませんでした。その理由として[123I]β-CIT SPECTを用いて評価した中脳でのセロトニントランスポーターの占有率は継続群(中央値82.2%)と増量群(中央値72.7%)とで有意差がなかったためとされています。
・エスシタロプラムについてはBoseらが重症うつ病に対する介入試験を報告しています(Clin Drug Investig. 2012 Jun 1;32(6):373-85.)。
・この試験では571名の18-65歳のMADRS30点以上の重度の大うつ病患者が対象となりSingle blindで2週間エスシタロプラム10mgが投与されMADRSが50%以上改善しなかった群(N=474)がdouble blindでエスシタロプラム20mg(N=229)ないしデュロキセチン60mg(N=245)を8週間投与され寛解率が比較されました。
・その結果、寛解率はエスシタロプラム20mg群が54%、デュロキセチン60mg群が42% で有意差を認めました。2週間でエスシタロプラム10mgに反応しない群は、デュロキセチンへの変薬よりも20mgに増やした方がいいかもしれないという結果でした。
・ただしこの試験ではエスシタロプラム10mg継続群が設定されていないため、そのままの用量で継続した場合の治療効果がわからないため、単に用量を増やせばいいかどうかという疑問に対する結論は得られません。
・Kimらは大うつ病患者98名を対象に、4週間オープンでエスシタロプラム10-20mgを投与し、MADRS9点以下の治療反応基準を満たさなかった群をエスシタロプラム20mg群(N=25)とエスシタロプラム30mg群(N=25)とに無作為割付し、6週間で治療効果を評価しました(J Affect Disord. 2019 Dec 1;259:91-97)。
・その結果エスシタロプラム20mg群のMADRS変化量は平均8.0点、エスシタロプラム30mg群のMADRS変化量は平均-11.8点で有意差を認めました。
・エスシタロプラムの用量とセロトニントランスポーターの占有率については、Kimらの報告(Clin Pharmacokinet. 2017 Apr;56(4):371-381)があり、20mg以上の用量によりようやく線条体でのセロトニントランスポーター占有率が80%を超える(リガンドは[11C]DASB)と報告されています。
・以上からエスシタロプラムは臨床用量である20mgまでの範囲においては、治療効果が用量依存性に増大することが期待できるのかもしれません(QT延長も用量依存性に増悪する点には要注意ですが)。
・セロトニントランスポーター占有率と臨床効果についての関連性については、エスシタロプラムのようにセロトニントランスポーターへの選択性が高い薬剤であれば、ある程度直接的に関連付けた議論ができるのかもしれませんが、ボルチオキセチンやSNRIなどその他のトランスポーターや受容体への結合親和性もみられる薬剤であれば、セロトニントランスポーターだけでは議論できないため、注意が必要となります。
・またここで議論された用量効果関係については個別の患者に対してそのまま適応することはできず、Saruwatariらが報告(Pharmgenomics Pers Med. 2014 May 28;7:121-7.)したように、CYP遺伝子多型により薬物の代謝が異なり、その結果同一用量でも血中濃度が大きく(2倍以上)違いうることにも注意が必要であり、一部患者においてはより高用量において有効性が期待される可能性があることに注意が必要です。
・そのためSSRIの用量は副作用に注意しつつ、やはり個別に設定する必要があるということになります。
・さらにセロトニントランスポーターの占有率と臨床効果を直接的に結びつけることはできない可能性もあります。
・PETやSPECTを用いたセロトニントランスポーターの占有率は、定常状態における数値であり、うつ病の病態がセロトニンなど神経伝達物質の動的な異常をきたしているものの場合、病態の本質をみていない可能性もあります。
・計測しているのはあくまでトランスポーターであり、セロトニンそのものが定量化されているわけではありません。
・このような考察をする背景に、Dankoskiらの興味深い報告(Neuropsychopharmacology (2014) 39, 2928–2937)があります。
・マウスを用いた基礎実験ではありますが、in vivo voltammetryを用いて、直接セロトニン動態をリアルタイムで検出しようとしている点で興味深いものです。
・実験では4-5週齢の雄マウス(N=76)が用いられました。うち40体は孤立した環境におかれ、36体はペアで飼育されました。20日間シタロプラム(15mg/kg/day)ないしプラセボが投与され、その後ガラス玉覆い隠し行動試験により不安関連行動の評価、オープンフィールド試験での行動量評価などが行われ、同時にin vivo voltammetryにより、背側縫線核の電気刺激により放出されるセロトニン量が定量されました。
・その結果、ガラス玉覆い隠し行動試験により評価された不安様行動は、ペア環境下のシタロプラム投与群において、プラセボ群と比較して埋められたガラス玉の数は有意に少なく、一方で孤立環境下でのマウス群においては、プラセボ群と有意差を認めませんでした。
・オープンフィールド試験では、シタロプラム投与群における全体的な運動量の減少は有意ではなく、ガラス玉覆い隠し行動試験の結果が単にシタロプラムによる行動抑制ではないことを示唆する結果がえられました。
・また、in vivo voltammetryにより、背側縫線核の電気刺激により放出されるセロトニン量を評価したところ、ペア環境下のシタロプラム投与群においては、有意なセロトニン放出量の増加を認めましたが、孤立環境下のマウスでは、シタロプラム投与群と非投与群とでセロトニン放出量の有意差はみられませんでした。
・以上の結果は、SSRIが効果を発揮するためには、孤立しないような、社会的環境が重要ではないかとの解釈が可能です(あくまでマウスの結果なので単純にヒトに当てはめることはできないとは思いますが)。つまり薬物療法が効果を発揮するには、心理社会的介入もしくは孤立しないような環境が必要であると結論を外挿できなくもありません。
・また、SSRIの効果がこのように動的な変化としてのみとらえられるのであれば、単にセロトニントランスポーターの占有率を評価したところで、それを効果に結びつけることはできないことになります。
・今後直接的に脳内セロトニンの動態がリアルタイムで定量化できる技術が開発されれば、興味深い知見が得られるようになるかもしれません。
-
うつ病の病態生理について
2020年10月18日
・2020年8月号のAmerican journal of psychiatryにUniversity of TexasのDr.Nemeroffがうつ病の病態生理についての現時点での理解に関する総説(文献1)を報告されていたので、ざっと要約してみます。
・10月6日付の当ブログの神経炎症についての記事の中で、統合失調症患者のアストロサイトをマウスに移植したらどうなるかみたいなことを書いていましたが、この総説の中に、「うつ病患者由来のエクソソームを正常マウスに投与したところ、強制水泳試験、テールサスペンション試験などにおいて、うつ病様の行動が観察され、さらに、健常対照者のエクソソームまたはmiR-139-5pのアンタゴニストを投与することで、マウスのうつ病患者からのエクソソームのうつ病類似症状惹起作用が阻害されたことも報告されている(Neuropsychopharmacology 2020; 45:1050–1058)」との記載があり、これには驚きました。
・再現性がどうなのかということと、細胞レベルで何が起きているのかがわからないことには何ともいえませんが、今後の進展がどうなのか気になるところです。
・最後のまとめの段落で、抗うつ薬の作用機序は不明であると言い切っておられるところが印象的であり、現段階での到達地点を謙虚に表している言葉かと思われます。
・今後、単一核トランスクリプトミクスやメチロームワイド関連研究などにより、うつ病の病態に関して新たな知見が加わることが期待されます。
基本的事項
・うつ病はヒポクラテス(紀元前460~377年頃)、ガレン(紀元129~199年頃)、イシャーク・イブン・イムラン(紀元10世紀)によって認識されており、これらの医師の初期の臨床記述は、喜びを感じる能力の喪失、重度の不快気分、意欲の喪失など、今日のものをよく反映している。これらの症状は重度の死別反応と似ているが、明確な誘因がない点で異なる。
・DSM-Vにおいては、気分の日内変動や原因不明の啼泣などのうつ病の一般的な症状は診断上必須ではない
・DSMによるうつ病は異質性を含むものであり、診断上の組み合わせだけでも1500通り以上との報告もあり、またあるものは食欲低下し、あるものは食欲亢進した状態、あるものは不眠、あるものは仮眠といった多様性が許容されている
・ある大規模疫学研究ではDSMないしICDにより診断されるうつ病の12カ月罹患率は6.6%であり、生涯罹患率は16.2%と報告されている。WHOは12カ月罹患率を5.5-5.9%、生涯罹患率を11.1-14.6%と報告している
・平均発症年齢は25歳で女性が男性の2倍であるとされている
・うつ病は併存症の多い疾患であり、PTSDやパニック症、全般不安症などの合併が多いことが知られている。このような併存症のある患者を臨床試験から除外してしまうと、臨床試験の結果が一般のうつ病患者層に適応できないことになりかねない。そのため多くの臨床試験ではこれら併存疾患の合併は許容されているが、併存がある場合とない場合とで病態生理が異なるのではないかとの問題も生じる
・うつ病の発症脆弱性リスクとして遺伝要因が知られており、遺伝要因の関与は35%~40%とされている。残りのリスクは環境的要因であり、幼少期の虐待歴、物質・アルコール乱用、最近の生活上のストレス因子、社会的孤立、大気汚染、社会経済的地位、学歴などの多くの要因が含まれる。
・これらの因子が遺伝的脆弱性とどのように相互作用して、大うつ病発症閾値に影響を与えるのかは興味深い課題である。
・うつ病に併存しうる様々な疾患やうつ病による自殺も問題であり、うつ病患者は非罹患群と比較して平均8年早く死亡するとの報告がある
動物モデル
・様々な動物モデルが提唱されているが、動物モデルが示す食欲や性的行動の減少、運動量減少などがヒトの主観的体験と関連したものかどうかはわかっていない。
・また自殺関連事象や集中力低下、罪業感、自責感などは動物モデルでは再現不能である。ヒトで観察される性差についても明らかではない
・これら動物モデルとヒトのうつ病との間に多くの乖離があるにも関わらず、薬物探索においては動物モデルが利用されており、この手法は有用と考えられている。しかしながら、実際には臨床的に効果がある薬剤が開発されても、動物モデルで効果がなければ実用化されない可能性もある。
・最近の興味深いアプローチとして、うつ病患者からのエクソソームを実験用マウスに投与する手法がある。
・エクソソソームは、ニューロンやグリアを含む多くの細胞タイプから放出される、蛋白質、DNA、mRNAなどを含む40~100nmの小胞である。
・ある報告では、うつ病患者のエクソソームにおいて対照者と比較して異なる発現量を示すマイクロRNAとしてhas-miR-139-5pが報告されている。
・うつ病患者由来のエクソソームを正常マウスに投与したところ、強制水泳試験、テールサスペンション試験、NSFなどにおいて、うつ病様の行動が観察された。さらに、健常対照者のエクソソームまたはmiR-139-5pのアンタゴニストを投与することで、マウスのうつ病患者からのエクソソームのうつ病類似症状惹起作用が阻害されたことも報告されている(Neuropsychopharmacology 2020; 45:1050–1058)
うつ病と遺伝子
・うつ病の1/3は遺伝的要因との関連が報告されているが、このリスクを媒介する遺伝的基質が特定されていないという問題がある
・ゲノムワイド関連研究(GWAS)は、大うつ病のリスクをもたらす遺伝子座を特定するために、比較的大規模なサンプルを用いて試みられてきた。その結果はいくつかの点で期待外れであった。
・第一に、初期の研究では、大うつ病と双極性障害および統合失調症の両方のリスクに重複があるように思われた。
・第二に、同定されたそれぞれの遺伝子変異(一塩基多型)は、対象者の数が多いため統計的には有意であるが、それだけでは大うつ病に対する脆弱性という観点からは非常に小さな影響のみであること(そのためにpolygenic risk scoreなどが提唱されている)
・第三に、統合失調症、自閉スペクトラム症とは異なり、大うつ病におけるエクソームシークエンシングによるコピー数変異や大きな影響を持つ稀な変異の同定は、期待されていたほど確固たる結果をもたらさなかった。
・近年のゲノムワイド関連研究では、いくつかの意義のある結果も報告されている。
・Howardらは807553名を対象とした研究(患者246363名、対照群561190名)により、シナプス構造や神経伝達に関与していると以前に報告されたいくつかの遺伝子を含む、102の独立した変異、269の遺伝子、およびうつ病に関連する15の遺伝子セットを同定した。同様に130万人を対象とした大規模研究においても、102のうつ病関連遺伝子変異のうち87個がリスク因子であることを同定した。しかしながら同時に、これら遺伝子変異が統合失調症、ADHD、双極性障害などにおいても共通したリスク因子となりうることも報告されており、うつ病に特異的な変異の同定には至らなかった
・5303名の漢族の女性を対象とした研究ではうつ病リスクと関連する2つの遺伝子座が同定された。この報告の特徴は、反復性かつ重度の女性うつ病のみを対象としたことで、よりサンプルの表現型の均質性が保持されている点である。大うつ病のリスクと関連する2つのゲノムワイド遺伝子座は、両方とも10番染色体上にあり、1つはSirtulin 1遺伝子(SIRTI)の近くにあり、もう1つはホスホリジンホスホヒスチジン無機ピロリン酸リン酸化酵素遺伝子(LHPP)のイントロン内にあった。
・コルチコトロピン放出ホルモン(CRH受容体1[CRHR1])多型と児童虐待やネグレクトの既往との相互作用は、大うつ病への脆弱性の増加をもたらすと考えられており、このようなアプローチは、polygenic risk scoreによるリスク評価を補完しうるものになる可能性がある。
・Polygenic risk scoreを含めたゲノムワイド関連研究からの知見は大うつ病の遺伝率のごく一部を説明しうるにすぎないが、遺伝子と環境の相互作用とエピジェネティックなメカニズムの役割を理解することによってこのギャップが埋められる可能性がある。
・エピジェネティクスの観点から、Abergは1132名のうつ病患者と対照群、61名の死後脳(ブロードマンエリア10)などを対象とした最初の大規模なメチロームワイド関連研究(全ゲノムにおけるメチル化状態を解析するもの)を報告した。その結果、中等度の効果量を有するうつ病関連CpGジヌクレオチドメチル化部位が同定された。
・またメチル化リスクスコア(methylation risk score)により、6年後の大うつ病罹患リスクを評価する試みも行われている。これら同定されたリスク部位とゲノムワイド関連解析によって見出されたリスク遺伝子と重複しており、それら遺伝子は神経炎症や自己免疫疾患と関連する遺伝子を含んでいる
・最近、Czamaraら(未発表データ、2020年1月)は、1,074人の5つの独立したコホートを調査し、児童虐待と遺伝子型がDNAメチル化に及ぼす影響を調べた。遺伝子による虐待と遺伝子型の相互作用は、80%のDNAメチル化部位の変動を説明し、発達とシナプス機能に関連する遺伝子にマッピングされていた。
・Tureckiらは、最近、大うつ病の男性17人と対照者17人の背外側前頭前野を対象とした単一核トランスクリプトミクス(全mRNA発現を解析)研究の結果を報告した。8万個以上の核がサンプリングされ、26個の細胞クラスターが同定され、60%以上が群間で遺伝子発現の差を示した。
・最大の影響は深層興奮性神経細胞とオリゴデンドロサイト前駆細胞で観察された。このような研究により、細胞特異的な大うつ病における遺伝子発現異常が明らかになることが期待されている
幼少期の虐待とネグレクトの影響
・大規模メタ解析などで幼少期の虐待と大うつ病発症との関連性が報告されている
・Peyrotらは、polygenic risk scoreと小児期の心的外傷、およびうつ病発症との関連を患者1645名、対照群340名について解析し、PRSおよび心的外傷それぞれが大うつ病発症と有意な関連を示したが、心的外傷を有するとPRSのうつ病発症への影響が大きくなることを報告した
・さらに幼少期の逆境体験は、うつ病の経過に影響することが報告された。つまり早期発症、入院率の高さ、自殺企図率、治療抵抗性(薬物療法、心理療法いずれも)などに関連することが報告された。
・動物実験と臨床試験において幼少期の逆境体験は脳構造および機能的変化、免疫機能、炎症、神経内分泌系、自律神経系などに長期にわたる永続的な影響を及ぼすことが分かっている。これらの影響はうつ病において報告されている海馬体積の減少などに寄与しているかもしれないが、因果関係はよくわかっていない
モノアミン仮説はどうなっているか
・モノアミン仮説はうつ病の病態仮説としては不完全である。例えば、セロトニン、ドーパミン、ノルエピネフリンの95%を脳内で枯渇させるレセルピンは、約15%の被験者にしかうつ病を発症させない。
・SSRIのセロトニントランスポータ阻害作用は即時的に発揮するが、抗うつ作用は週単位で遅れて発現する。また未治療大うつ病患者でも、SSRIとSNRIで寛解が達成されるのは50%以下である。
・また未治療患者においてエスシタロプラムとデュロキセチン投与後に、セロトニンおよびノルエピネフリントランスポーターの占有率と治療反応性との関連性がないことを示唆する結果が報告されている(Neuropsychopharmacology 2014; 39:S460–S461)
・うつ病患者においてモノアミン系の活動に関する指標は変化していないことを示唆する結果が多く報告されている
・ケタミンなどセロトニン系以外に作用する抗うつ薬が上市されている。
・これらの知見はいずれもモノアミン仮説にとっては逆風となる
・Moriguchiらは最近、新規放射性リガンド([11C]SL25.1188)を用いて未治療大うつ病患者20人と対照群20人についてMAO-B活性を評価した。患者群ではMAO-B活性の著しい上昇が認められ、患者の50%では前頭前野のMAO-B活性値が対照群の最高レベルよりも高かったことが報告されている。
・また抗うつ薬の作用機序におけるドパミンD1受容体とセロトニン5A受容体の役割が最近注目されている(Mol Psychiatry 2020; 25:1229–1244、Mol Psychiatry 2020; 25:1191–1201)
脳画像研究
・これまでの画像研究に対する著者の批判的な意見が述べられている。
・まず第一に、うつ病における体積変化の効果量は一般的に非常に小さいこと。
・第二に、メタ解析は、知見の多くを広く支持していないこと。
・第三に、最も重要なことは、例えば、海馬や前頭前野の体積変化は実際に何を意味するのか?樹状突起や軸索の萎縮なのか?神経細胞の変性なのか?神経細胞に対するグリアの比率の変化なのか?細胞骨格の変化なのか?これらの疑問を解決するために、構造的MRI所見と病理組織学との関連を精査した死後脳研究は存在しない
・fMRIでは、大うつ病における前帯状皮質膝前部および視床とデフォルトモードネットワークの機能的接続性の増加、前頭頭頂部タスク制御ネットワークの機能的接続性の低下、前頭頭頂部制御ネットワークとデフォルトモードネットワークの機能的接続性の変化などが報告されている。しかしこれらの変化がうつ病によるものなのか、幼少期の虐待などの影響なのかはわからない。
・Rappaporらは、現在のうつ病の重症度は、報酬を期待することに反応して側坐核の活動低下と関連しているのに対し、反復性のうつ病は皮質線条体回路における報酬を期待することへの反応の低下と関連していることを報告した(Am J Psychiatry 2020; 177:754–763)
免疫系と炎症について
・20年前に著者らはうつ病患者と癌患者でうつ病を併発した患者についての研究において、うつ病患者においては炎症促進性サイトカインである血漿中IL-6が増加していることを報告した
・その後うつ病における様々な免疫系指標の変化が報告されている。複数のメタ解析により、大うつ病患者では炎症性サイトカインおよび急性期蛋白質、特にIL-6、腫瘍壊死因子(TNF)およびCRPの増加が報告されている。
・うつ病では末梢血単核球における炎症性サイトカイン遺伝子発現が増加しているという報告もある。
・しかしながら、すべてのうつ病患者がこの特徴を示すわけではない。
・自殺傾向が顕著な患者の血中およびCSF中の炎症性サイトカイン濃度が著しく上昇しているとの報告もある。
・同時にうつ病ではナチュラルキラー細胞の減少など免疫抑制状態にあるとの報告もある。
・炎症促進性サイトカインの上昇は、統合失調症や双極性障害など他の精神疾患でも報告されていることに注意が必要である。
・in vitroの研究だが、うつ病患者由来血漿を健常者の末梢血単核球に曝露すると免疫抑制作用が観察された。
・うつ病の既往が感染症リスクの増加と関連しているとの多くの報告がある。このことはうつ病患者が免疫抑制されていることを意味すると解釈されるが、炎症性サイトカインの増加所見とは矛盾しており未解決である。
・またうつ病患者は、全身性エリテマトーデス、関節リウマチ、自己免疫性甲状腺炎、多発性硬化症などの自己免疫疾患を発症するリスクが高いことが報告されている。
・末梢性炎症性サイトカインの上昇がCNSに影響を及ぼし、炎症に関連したうつ病を媒介する可能性がある。血液脳関門を通過しないTNF拮抗薬を含む抗炎症性治療薬が、特に炎症が亢進している証拠のある大うつ病患者において、抗うつ特性を有することを示唆する報告もあるが、エビデンスとしては不十分である
・幼少期の心的外傷と炎症との関連も注目すべきである。幼少期の心的外傷が炎症促進性サイトカイン分泌の長期的な増加をもたらすことが、基礎実験および臨床において報告されている
まとめ
・最後に著者が全体をまとめて以下のように要約している
・うつ病の診断は、顕著な異質性のために、依然として困難である。反応と寛解の定義は恣意的であり、それらの尺度の有用性について深刻な疑問が残っている。治療抵抗性うつ病の定義はまだ一般的には合意されていない。また、PTSD、強迫症、社交不安症、全般不安症など、うつ病の併存疾患を臨床研究や診療でどのように扱うかは不明である。NIMHの提示した研究用基準は有用かもしれないが、臨床実践を変えるわけではない
・うつ病患者のうち、適切な単剤療法試験で寛解を達成しうるのは少数である。したがって、標準治療はおそらくほとんどの患者にとって最適ではないと結論せざるを得ない。多くの増強戦略があり一部の患者には有効であるが、副作用を伴う。
・抗うつ薬の作用機序は不明である。抗うつ作用に関する理論はいずれも立証されていない
・うつ病における個別化医療、すなわち、うつ病のリスクのある患者を特定し、個々の患者に最適で安全な治療法を選択できるようにすることはまだ達成されていない。
・前述の欠点の多くは、大うつ病の病態生理の理解が不十分なことに起因している。40年に及ぶ研究にもかかわらず、うつ病の根本的な病因はいまだに不明である。しかし、ゲノミクスのエピジェネティクス、炎症、環境因子の研究ではかなりの進歩がみられている。
・男性と比較して女性の大うつ病の有病率が高い要因は未だ不明である。
・うつ病と主要な身体疾患の併存率が高いことのメカニズム研究は非常に不足している。これは、国立衛生研究所がこの分野の研究を行っていないこともあり、研究資金が限られていることが原因である
引用文献
1)CB. Nemeroff, Am J Psychiatry 2020;177:671–685; doi:10.1176/appi.ajp.2020.20060845 -
国内2剤目の双極性障害維持療法期承認薬剤
2020年10月12日
・今年9月25日に大塚製薬のアリピプラゾールLAIが国内でラモトリギンについて2剤目に双極性障害維持療法期における薬剤として適応承認されました。
・現在FDAないし厚労省にて承認されている薬剤は下図(ジプラシドンは入っていなくて、その他一部もれがあるかもしれませんが)となり、ようやく国内でも承認された薬剤の範囲で躁病急性期から維持療法期まで連続的に同一薬剤で治療の継続が可能となりました(もっとも実際にはガイドラインが推奨するように、リチウムなどをオフラベルで維持療法期に使用するケースが多いと思いますが)。ちなみに下の図は赤色がFDAのみ承認、青色がFDAと厚労省が承認、黄色が厚労省のみ承認(2020年10月段階)となります。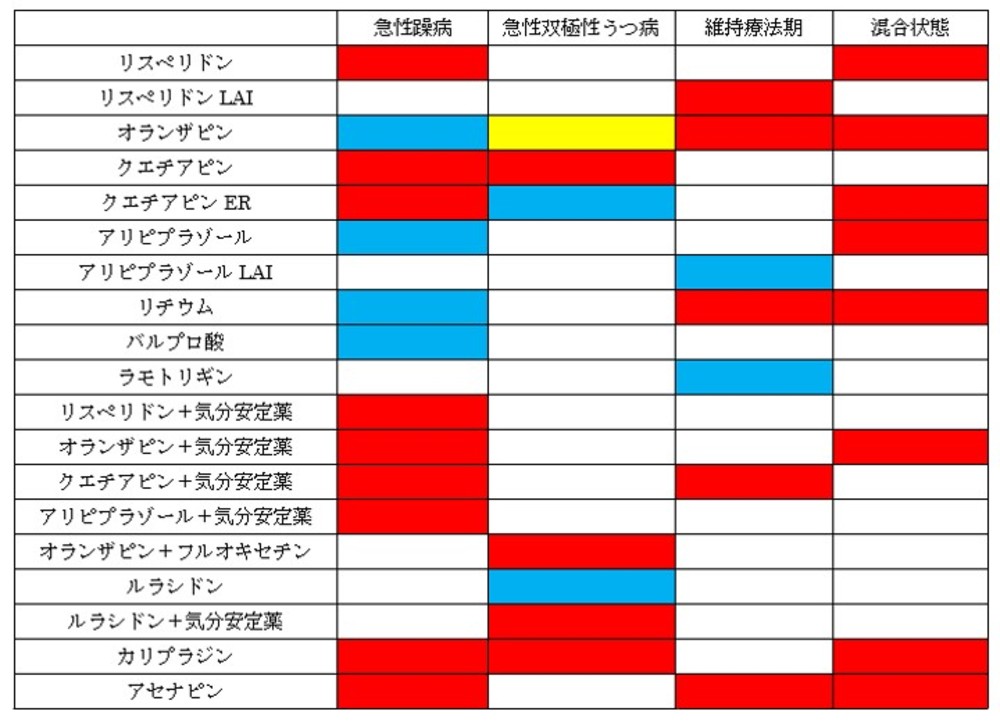
・当記事に関しては、特定の薬剤に関する記事になりますので、COI開示もしておきます。著者のCOI関係にある企業として大塚製薬株式会社(講演料)となります。そのような状況ですが、解析対象とした臨床試験はおそらくselection biasはないものと思いますので、現時点で結果の普遍性はあると思われます。
・ラモトリギンの双極性障害維持療法期におけるあらゆるエピソードに関する再発予防効果と、アリピプラゾールLAIの双極性障害維持療法期における再発予防効果は、現在までのエビデンスで同等なのか、それともどちらかが優れているのか、について直接比較した試験がないので、ネットワークメタ解析を行ってみました。
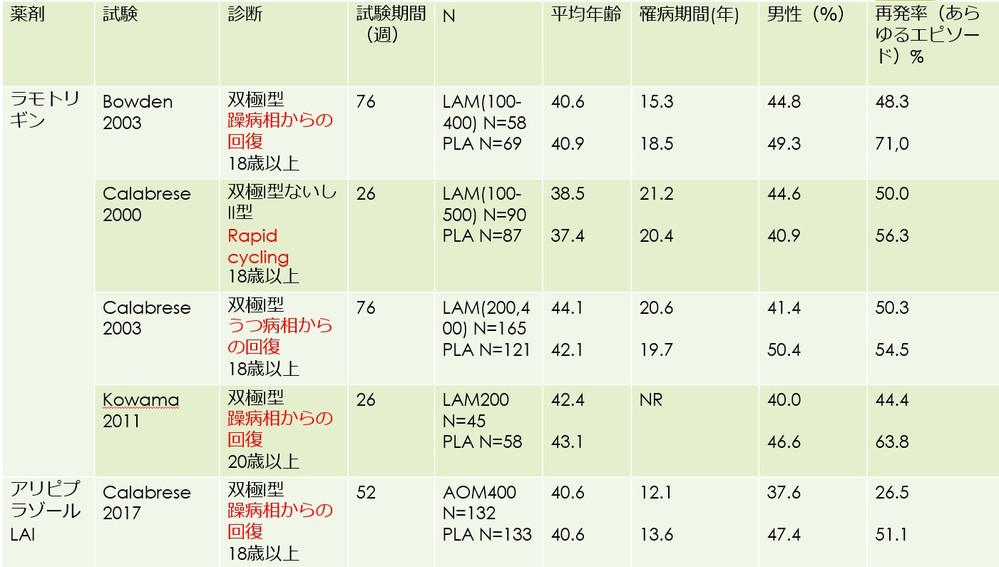
・ラモトリギンの維持療法期の介入試験については、ありがたいことに藤田医大のOya先生らが文献1にて報告されています。ここに掲載された試験と、アリピプラゾールLAIのこれまでに報告された維持療法期のおそらく唯一の介入試験である国際第3相試験(ATLAS試験)の結果を用いて解析をしてみます。
・解析対象となった試験の概略は以下となります(文献1とNなどがちょっと違うのは、エントリー後に対象薬剤が投与されなかったケースなどを除いたためです)
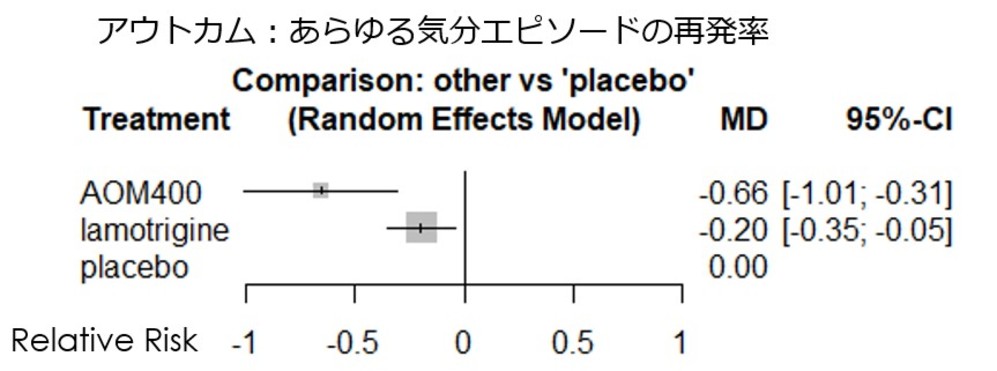
・使用ソフトはRでnetmetaパッケージを用いて、頻度論によるネットワークメタ解析をrandom effectsモデルで解析してみました。評価尺度はあらゆるエピソードの再発率のプラセボに対する相対リスクとなります。
・その結果、下図の通り、現段階ではアリピプラゾールLAIはラモトリギンよりも有意にあらゆるエピソードの再発を防ぐ効果があるかもしれないとの結果になりました。
・解析対象となった試験の異質性に関する尺度であるI2統計量は0.7%であり、問題ない数値でした。しかしながら、解析対象としたラモトリギンの介入試験のサンプルの均一性には問題があり、アリピプラゾールLAIの第3相試験が急性期が躁病エピソードであり、その後の維持療法期間において介入試験を行っているのに対して、ラモトリギンについては急性期エピソードが躁病であるstudyは2つであり、残りはrapid cyclingやうつ病相から入っており、そこでの治療に反応した患者群が対象となっているため、そこに異質性が存在する可能性があります。
・したがって、解析対象を急性期が躁病の studyのみとして、ネットワークメタ解析を行った結果が以下となります。どちらも対プラセボでは有意となりすが、アリピプラゾールLAIとラモトリギンとの有意差は消失しました。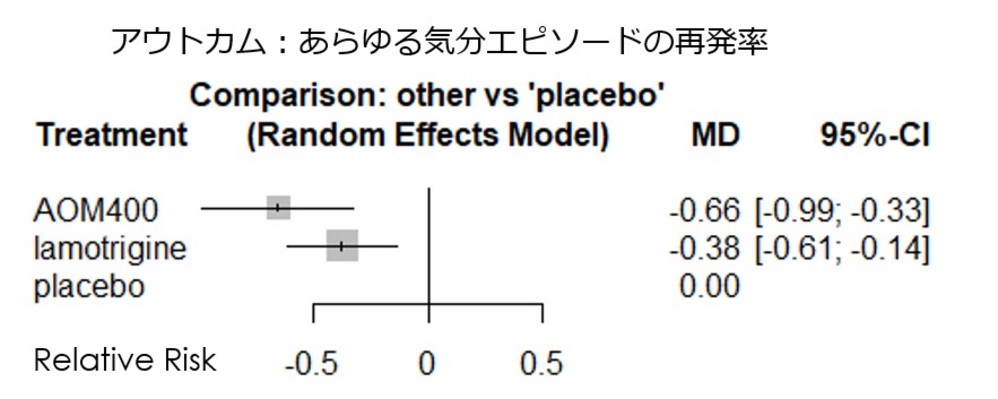
・前回の維持療法期におけるネットワークメタ解析の報告(文献2)からだいぶ時間もたっているので、そろそろアリピプラゾールLAIなども入った最新の結果が報告されるのではないかと思われます。引用文献
1)Oya K, Sakuma K, Esumi S, et al.Efficacy and safety of lithium and lamotrigine for the maintenance treatment of clinically stable patients with bipolar disorder: A systematic review and meta‐analysis of double‐blind, randomized, placebo‐controlled trials with an enrichment design. Neuropsychopharmacol Rep. 2019;39:241– 246. https://doi.org/10.1002/npr2.12056
2)Miura T, Noma H, Furukawa TA, Mitsuyasu H, Tanaka S, StocktonS, et al. Comparative efficacy and tolerability of pharmacological treatments in the maintenance treatment of bipolar disorder: a systematic review and network meta‐analysis. Lancet Psychiatry. 2014;1(5):351–9. -
神経炎症について
2020年10月06日
・うつ病にも神経炎症仮説があって、双極性障害にも神経炎症仮説があって、統合失調症にも神経炎症仮説があって、ALSにも神経炎症仮説があって、どれもこれも神経炎症仮説で疾患の表現型が違うのでモヤモヤしてしまうのですが、神経炎症仮説についての研究をするのであれば、これら疾患表現型の違いがなぜ生じるのかを説明しうるような研究がでてくるといいなと思うところではあります。
・例えばヒトALS患者由来アストロサイトをマウスに移植するとALS類似の病態が再現されることが知られていますが(J Clin Invest. 2015 Mar 2;125(3):1033-42)、同様に統合失調症患者由来アストロサイトをマウスに移植すると統合失調症モデルマウスになるのでしょうか?
・ALSについては様々な抗炎症作用が期待できるであろう薬物の介入試験が行われてきて(過去にまとめたことがあるのですが、調べた限り、olesoxime、ミノサイクリン、低用量インターロイキン2、tocilizumab(関節リウマチ治療薬:抗ヒトインターロイキン6モノクローナル抗体)、anakinra(IL-1受容体アンタゴニスト)、acthar(副腎皮質刺激ホルモン)、celecoxib、glatiramer acetate(多発性硬化症治療薬)、サリドマイド(TNF-αの発現減少作用)、NP001、fingolimod(多発性硬化症治療薬)、免疫抑制剤(バシリキシマブ+プレドニゾロン+タクロリムス+ミコフェノール酸)、masitinibなどがあります)、celecoxib、glatiramer acetate、サリドマイド、fingolimod、tocilizumab、anakinra、ミノサイクリン、olesoximeについてはnegativeな結果であり(小規模で再検証を要するものも多いのですが)、NP001では高用量かつ高感度CRPがベースラインで高い群では効果があるかもしれない、masitinibについては試験方法に問題あり要再試験などとなっています。
・これらは抗炎症作用が期待できる薬物ですので、バイオマーカーとしてもそれに関連したものがいろいろと用いられており、末梢血T細胞比率、髄液中サイトカイン濃度、髄液中プロスタグランジンE2濃度、末梢血高感度CRP濃度,末梢血リポポリサッカライド濃度、末梢血単核球中サイトカイン遺伝子発現、血清中サイトカイン濃度、髄液中可溶性インターロイキン6受容体濃度、PETによるトランスロケーター蛋白質(ミクログリア活性化の指標)測定、末梢血制御性T細胞比率、血清中ニューロフィラメント軽鎖濃度、血清中リン酸化ニューロフィラメント重鎖濃度、などなど、使用された薬剤にもよりますが、様々なマーカーが用いられています。
・これらのうち、末梢血によるマーカーについては果たして中枢神経由来なのか、という疑問を伴います。やはり神経炎症ですから、髄液中のマーカーなど中枢神経に特異的なマーカーが望ましいかと思われます。
・うつと神経炎症仮説について臨床試験の観点から少し眺めてみます。
・モノクローナル抗体による抗サイトカイン療法についての介入試験でうつを評価尺度にしたものは2018年までで二重盲検試験では10個くらいあるようです。
・うち4つが乾癬を対象とした介入試験であり、3つは関節リウマチを対象した試験で、その副次評価項目としてうつ尺度が含まれているものですが、うつ病(治療抵抗性)を対象としたものは1つしかなく、さらに規模の小さなものです(JAMA Psychiatry. 2013;70(1):31-41.)。
・うつ病を対象としたinfleximabの有効性について報告したこの試験の結果は全体としてnegativeであり、ベースラインのCRPが高いほど治療効果が高まる傾向がみられたとの結果でした。あくまで有意差はなく、規模が小さいので有効性についての結論は得られないというのが正しいところかと思います。
・うつ症状に対する抗サイトカイン療法の7つの介入試験のメタ解析の結果(Molecular Psychiatry (2018) 23, 335–343;)では、全体の効果量が0.40(CI 0.22-0.59)と有意差を認めていますが、7つ中4つは乾癬、1つはアトピー性皮膚炎、1つはクローン病を対象とした介入試験であり、副次評価項目としてうつ尺度が含まれているものになります。従って実際にうつ病患者がどの程度含まれていたのかはわからないということになり、結果の一般化は困難と思われます。
・双極性うつ病を対象とした抗サイトカイン療法(infleximab)の介入試験の結果が昨年公表されました(JAMA Psychiatry. 2019;76(8):783-790)。結果は全体としてnegativeであり、身体的ないし性的虐待の既往のあるサブグループでは治療効果が有意であったとの結果でした。ベースラインのCRPと治療効果との相関は有意ではありませんでした。
・また今年に入って、双極性うつ病を対象としたミノサイクリンおよびcelecoxibの併用ないし単剤療法の有効性についての介入試験の結果が報告されました(Lancet Psychiatry 2020; 7: 515–27)。結果はHAM-D17においていずれの群も12週間でプラセボとの有意差を見出すことはできませんでした。
・これに対しては今月のlancet psychiatry誌にてベースラインのCRPなどで層別化し、炎症の高いサブグループで効果を検証すべきであるとのコメントが掲載されました。これに対する著者らの反論は、CRPがそもそも神経炎症の指標である保証はなく、何をもってベースラインの神経炎症が高い群とすればいいのかわからないため、きちんと神経炎症のバイオマーカーを同定すべきであるとのことでした。
・うつ病患者においてはCRPが1mg/L以上の患者が60%、5mg/L以上が30%とのことです。しかしこのCRP上昇がどこから来ているのか、わかりません。
・そもそもCRPは主に肝臓でつくられるものじゃなかったのかというのが、学生レベルの知識しかない私の感想なのですが、どうなのでしょうか。
・ミノサイクリンについては、治療抵抗性うつ病に対する増強療法としての有効性を検証した小規模介入試験の結果が報告されており(J Psychopharmacol. 2017 Sep;31(9):1166-1175)、こちらについては結果はpositiveでしたが、非常に規模が小さく(全体でNが40程度)、これについても有効性についての結論を出すことはできないというところかと思います。
・以上のように末梢血からのマーカーを用いる方法では議論が収束しそうにない状況ですので、きちんと中枢神経のバイオマーカーを用いる方法がないのかということになります。そこで思いつくのがPETによる方法です。
・うつ病についてのPETによる神経炎症研究は、ミクログリアの活性化指標とされる(これは最近では疑問視されていますが)トランスロケーター蛋白質に対する放射性リガンドを用いた報告があり、positiveな結果(JAMA Psychiatry. 2015 Mar;72(3):268-75.、Br J Psychiatry. 2016 Dec;209(6):525-526.)や軽度から中等症ではnegativeとする結果(Brain Behav Immun. 2013 Oct;33:131-8.)、希死念慮を伴う比較的重度のうつ病においては前部帯状回においてトランスロケーター蛋白質発現上昇がみられるとの結果(Biol Psychiatry. 2018 Jan 1;83(1):61-69.)などが報告されています。
・双極性障害でも右海馬でのトランスロケーター蛋白質発現上昇の報告(Brain Behav Immun. 2014 Aug;40:219-25.)があります。
・統合失調症では、未投薬患者においては、トランスロケーター蛋白質の発現低下を示唆する結果が報告(Mol Psychiatry. 2020 Jun 30.)されており、ミクログリアの発達ないし機能の障害を示唆するものではないかと考察されていますが、今後の検証を要するところかと思われます。また未投薬患者ではトランスロケーター蛋白質発現は対照群と有意差なく、投薬後に有意な上昇を示したとの報告(Mol Psychiatry. 2016 Dec;21(12):1672-1679. )もあり、統合失調症におけるトランスロケーター蛋白質の増加は投薬の影響をみているのではないかとの指摘もあります。
・閾値下の精神病超ハイリスク群(ultra high risk for psychosis)においては、灰白質でのトランスロケーター蛋白質の発現亢進がみられ、重症度に相関するとの報告(Am J Psychiatry. 2016 Jan;173(1):44-52.)もありました。
・トランスロケーター蛋白質発現上昇は統合失調症死後脳ではみられておらず、トランスロケーター蛋白質はミクログリアの活性化を特異的に反映したものではなく、in vitroの研究では活性化ヒトミクログリアにおいて発現亢進がみられないことなどから、統合失調症におけるミクログリアの活性化指標としては不適切ではないかということを指摘する論文も報告されています(Schizophr Res. 2020 Jan;215:167-172. )
・従って、より選択的なグリア細胞の活性化指標となるリガンドが必要ではないかということも指摘されています(Mol Psychiatry. 2018 Feb;23(2):323-334. doi: 10.1038/mp.2016.248. Epub 2017 Jan 17.)
・以上より、PETを用いた神経炎症の可視化については、まだまだこれからというところでしょうか。
・より特異度の高いPETリガンドが開発されれば、この分野の研究が進展し、本当に神経炎症が病態に関与しているのかどうかが明らかになるのかもしれません。




