-
いろいろ心配はされていますが
・昨日のaducanumabの承認を受けて、nature誌(doi: https://doi.org/10.1038/d41586-021-01546-2)もscience誌(https://www.sciencemag.org/news/2021/06/alzheimer-s-drug-approved-despite-doubts-about-effectiveness)もどちらかというと批判的な記事を公表しています。
・最も批判の対象となっているのは、その有効性についての根拠が乏しい点と、脳内アミロイドβの減少というアウトカムにより薬剤承認されてしまったため、他の製薬会社もこのような本来の治療効果ではない指標により、薬剤承認を目指すようになるのではないかという懸念です。
・nature誌の記事を引用すると”Biogen says that it will charge around US$56,000 per year per person for the drug. If 5% of the United States’ 6 million Alzheimer’s patients receive the treatment, the drug’s revenue would reach nearly $17 billion per year.”
ということで、全米600万人のアルツハイマー型認知症患者の5%がaducanumabを投与された場合、biogen社の利益は170億ドル(現在のレートで約1兆8600億円)になるとのことです
・また同記事では、Penn Memory CenterのJason Karlawish氏の発現を引用し、” Alzheimer’s patients might start dropping out of ongoing clinical trials to take aducanumab. Others worry that drug developers might abandon other targets.”とのことで、さらに別の研究者からの発言として、研究を10-20年後退させることになるのでは(他の治療ターゲットについての創薬が衰退することにより)との憂慮も掲載されていました。
・高額な薬ゆえに日本で保険収載された場合、日本の保険制度が崩壊するのではないかとの懸念も出ているようです。願わくば安価で提供されるといいのですが。その問題はさておき、私の個人的意見では、研究が後退するのではという点は杞憂かと思います。Biogen社に巨額の利益がもたらされた場合(それは当然多くの患者に良好なアウトカムをもたらした結果であるべきですが)、中枢神経疾患における他の治療対象をターゲットとした創薬も大きく進展する可能性があるためです。
・Biogen社では現在、アルツハイマー型認知症以外の神経変性疾患に対する多くの治療薬候補が同社のパイプラインを走っており、特にALSに対するアンチセンス・オリゴヌクレオチド製剤については、SOD1変異家族性ALSに対するtofersenの第3相試験、C9orf72遺伝子変異ALSに対するBIIB078(第1相)、ataxin-2 mRNAをターゲットにしたBIIB105(第1相)など他社の追随を許さない位置にいます(これら薬剤を開発したベンチャー企業を買収してきたためですが)。
・その他XPO1阻害薬であるBIIB100(第1相)など、細胞内封入体が特徴の神経変性疾患に対する創薬も積極的に取り組んでいるため、同社の研究資金が増え、αシヌクレイン(レビー小体型認知症、パーキンソン病(BIIB054、BIIB094)、多系統萎縮症(BIIB101))、TDP-43(ALS/FTLD)(BIIB105、BIIB100)、タウ(アルツハイマー、進行性核上性麻痺、皮質基底核変性症)など(タウオパチ―については一昨年進行性核上性麻痺に対するBIIB092がnegative resultとなり、難しいところのようですが)、この度のaducanumabなど細胞外アミロイドβを対象とした創薬のみならず、より難易度の高い細胞内封入体を特徴とする神経変性疾患に対する創薬が大いに進展することが期待されます。
-
抗うつ薬と心理療法
2021年06月08日
・5月号のJAMA Psychiatry誌に、完全または部分寛解状態にあるうつ病患者について、抗うつ薬をそのまま継続した場合と、抗うつ薬を減量し、そこに予防的心理療法を行う場合とで、平均15か月間での予後がどのように異なるかについてのメタ解析結果が報告されました(文献1)。
・結論は予想通りで、再発リスクに関して有意差なしというものでした。
・結論が予想できた背景には、2015年のBMJ誌の報告(文献2)の知見があります。まずはこの内容からみていきます
大うつ病に対する第2世代抗うつ薬とCBTの有効性比較(文献2)
背景
・毎年アメリカ人の7%が大うつ病に罹患し、治療を求めるのはその約半分といわれている
・さらに治療を受けた患者の20%ほどしか適切な治療を受けていないといわれる(薬物療法では、最低2ヶ月間の適切な薬剤による薬物療法と4回以上の診察、精神療法では、少なくとも1回30分以上で合計8回以上の専門家による精神療法施行)
・薬物療法では第2世代抗うつ薬(SSRI、SNRI、その他)が最も多く処方されている。2011年のメタ解析(Gartlehner G, et al. Ann Intern Med 2011;155:772-85)では、これら薬剤間で、有効性に関して有意な差はないとされている(注:より新しいメタ解析(文献3)やCANMATガイドライン(これについては文献3の影響などを大きく受けたものではありますが)については、ここでは明示しませんが一部の抗うつ薬が、別の抗うつ薬に対して有意に治療効果が優れている可能性が報告されています)
・今回、うつ病エピソードに対する初期治療としての、第2世代抗うつ薬とCBTの有効性の比較を行った
対象と方法
・18歳以上の大うつ病性障害患者
・第2世代抗うつ薬(ブプロピオン、シタロプラム、デスベンラファキシン、デュロキセチン、フルオキセチン、エスシタロプラム、フルボキサミン、レボミルナシプラン、ミルタザピン、ネファゾドン、パロキセチン、セルトラリン、トラゾドン、ベンラファキシン、ヴィラゾドン、ボルチオキセチンのいずれか)とCBTを直接比較したRCT
・11 RCTs(n=1511)
・HAM-D17で16-23点以上
結果
寛解率
・3つのRCTが寛解率を評価(n=432、寛解はHAM-D17で7点以下ないし7点未満で定義)
・試験期間は12-16週
・抗うつ薬群とCBT群で有意差はなかったが、数値的には抗うつ薬群が寛解率が高かった(47.9%対40.7%、risk ratio 0.98, 95% CI 0.73-1.32)
反応率
・5つのRCTが反応率を評価(n=660)
・試験期間は8-16週
・反応はHAM-D17 50% 以上の改善で定義
・反応率は抗うつ薬とCBTで有意差なし(44.2% 対 45.5%; risk ratio 0.91, 95% CI:0.77 - 1.07)
HAM-D変化量
・HAM-D変化量の差を2つのRCT(n=249)が報告・試験期間は8週間
・平均変化量の差( 0.38, 95% CI:2.87 to 2.10 )は有意差なし
長期経過
・2つのstudyが長期経過を報告
・1つは論理療法(rational emotive therapy:認知行動療法と治療的枠組みはほぼ同一)ないし認知療法と第2世代抗うつ薬を比較したもの。
・6ヶ月時点ではHAM-D17得点は精神療法群で有意に抗うつ薬群よりも低かった。寛解率や反応率は有意差なし
・もう1つは問題解決療法と第2世代抗うつ薬を比較したもので、1年時点での寛解率は問題解決療法群で高く、一方反応率は抗うつ薬群で高かった(いずれも有意差なし)
再燃率
・再燃率をみたものが1つ
・初期治療として、認知療法ないし第2世代抗うつ薬を使用し、最初1年間再燃がなかった群をさらにもう1年間フォロー
・初期治療として認知療法を受けた群の再発率は24%、抗うつ薬群は52%で、症例数が少なく有意差はなし(p=0.06)
中断率
・4つのstudyで評価。あらゆる理由による中断率は有意差なし(risk ratio=1.00)
・ただし副作用による中断は抗うつ薬群で多かった(有意差はなし)
・有効性欠如による中断についても有意差なし
抗うつ薬単独対抗うつ薬+CBTの比較
・3つのstudyあり。いずれも反応率、寛解率において有意差なし
・1つのstudyではMADRSの変化量において、併用群が有意に抗うつ薬単独群よりも大きな変化量を示したとの結論が得られている(しかしこのstudyはbiasが大きいという問題が指摘されている)
結論
・現在までに行われた11の直接比較のRCTによれば、大うつ病に対する初期治療として抗うつ薬がCBTよりも有意に優れているとの証拠はない。
・ただし、この結論はサンプルサイズが小さいことや、現段階ではエビデンスの質が低いことにより、決定的なものではない
・また、両者併用が抗うつ薬単独よりも優れていることを積極的に支持するエビデンスもなく、今後の検証が必要
・重症度により結論が変化する可能性があり(重症群ではそもそも初期からの精神療法的介入そのものが困難)、検証する必要あり
・以上の現状により、日本うつ病学会のガイドラインでもこの報告は引用されていない(しかし無視できる報告でもない)
・この報告が今後の検証においても正しいままであった場合、軽度~中等症のうつ病(HAM-D17で18点程度まで)においても、第1選択としてCBT単独として行うことは選択肢として除外できない、ということになる
うつ病再発予防における抗うつ薬と心理療法(文献1)
背景
・APA2010やNICE2009などのガイドラインでは、再発リスクの高い患者に対して、寛解後少なくとも2年間の維持療法として抗うつ薬を継続することが推奨されている(日本うつ病学会のガイドラインでもAPA2010を引用し、同様の記載となっている)
・抗うつ薬は副作用、安全性の問題や、漸減時に再発リスクが高まることが指摘されている
・うつ病の再発予防のための、心理学的介入(予防的認知療法、マインドフルネス・ベースド・コグニティブ・セラピー[MBCT]、ウェルビーイング・セラピーなど)を抗うつ薬の投与後に順次行うことも選択肢である。
・これらの介入は、抗うつ薬単独と比較して、抗うつ薬との併用で特に治療効果が高く、急性期治療後に抗うつ薬に追加することで、抗うつ薬単独よりも、より再発予防に効果的であることが報告されている(再発のリスク比 0.84で有意差あり。JAMA Psychiatry.2021;78(3):261-269.)
・しかし、どのような患者に対して抗うつ薬を漸減するのか、あるいは継続するのがよいかについてのエビデンスはない。
・再発うつ病の場合、治療効果に関連する修飾因子や予測因子を特定する試みがこれまでに報告されている。
・うつ病の再発リスクと関連する要因としては、以下のようなものが検討されている。発症時の年齢と過去のエピソードの数、成人(小児では関連なし)では初発エピソードの重症度、成人での(小児では関連なし)共存する他の精神病理(特に気分障害)の存在、うつ病や他の気分障害の家族歴(すべての年齢)は再発リスクの増加に関係、さらにネガティブな認知、神経症傾向が高いこと、社会的支援の不足、ストレスの多いライフイベントなども再発リスクとされている。一方で性別、社会経済的地位、配偶者の有無は、うつ病の再発の危険因子ではなさそうとされた(Clin Psychol Rev. 2007;27(8):959-985)
・その他、小児期の感情的なネグレクト、心理的虐待(Acta Psychiatr. Scand. 126, 198?207)、慢性疼痛や慢性疾患( BMC Psychiatr. 14, 1?9.)、残遺うつ症状(Behav Cogn Psychother.2019;47(5):514-529.)なども再発リスク因子として報告されている
・しかしメタ解析による結果は、全体を総括した結果であり、患者の個別性に応じた治療法の最適化に関する情報は得られない
・今回、Individual participant data meta-analysis(IPDMA)を用いて、抗うつ薬の漸減中または漸減後に心理学的介入を順次行うことが、抗うつ薬単独投与の代替となるかどうか、またどのようなケースに有効かを検証した
方法と対象
・完全または部分的に寛解しているうつ病患者(18~65歳)
・抗うつ薬漸減しながら予防的心理療法を行う場合と抗うつ薬単剤療法を比較した無作為割付比較試験 N=4 (n=714)
・平均追跡期間15カ月
・抗うつ薬継続群 n=369、抗うつ薬漸減ないし中止+マインドフルネスに基づく認知療法併用(n=287)、抗うつ薬漸減ないし中止+予防的認知療法(n=58)
・共変量として年齢、うつ病発症年齢、婚姻状態、治療セッションへの参加回数、性別、共存する精神疾患の有無、過去のうつ病エピソードの回数、学歴、寛解月数、HAM-Dで測定したベースラインの残存抑うつ症状を抽出
結果
・対象者の平均うつ病エピソード回数 5.6回。すべての参加者は寛解状態で、うつ病寛解得点を定義した試験は4つのうち2つで1つがHAM-Dで7点以下、1つは10点以下。寛解期間は6-8か月(1つは未定義)
・ランダム効果モデルでは、抗うつ薬漸減ないし中止+精神療法の抗うつ薬継続に対する再発のハザード比は0.86(95%CI,0.60-1.23)で有意差なし
・再発リスクに有意に関連した共変量としては、寛解月数、発症年齢、ベースラインの残存うつ症状であった
・これらリスク因子を有する場合でも、(例えばうつ病の残存症状が強く、過去のエピソード回数が多くても)、抗うつ薬漸減+心理療法により、再発のリスクの有意な上昇はみられなかった
結論
・うつ病の臨床的予後因子にかかわらず、抗うつ薬の漸減中および漸減後に心理療法を併用することにより再発リスクの上昇を防ぐことができる可能性があるコメント
・再発予防のために用いられた心理療法の大半がマインドフルネスに基づくもの(対象症例の83.2%)であったのは印象的でした。いわゆる第2世代の定型的な認知行動療法であればどうなのかについての結論もほしいと思いました(たぶん結論は変わりませんが)
文献1:Josefien J.F. Breedvelt et al. JAMA Psychiatry. 2021 May 19. doi: 10.1001/jamapsychiatry.2021.0823. Online ahead of print.
文献2:Halle R Amick et al. BMJ. 2015 Dec 8;351:h6019. doi: 10.1136/bmj.h6019.
文献3:Cipriani A et al. Lancet. 2018 Apr 7;391(10128):1357-1366 -
これは驚いた
・つい1時間前ですが、biogenとエーザイの開発したaducanumabがFDAにより条件付き承認を得たとの衝撃的ニュースが世界中を駆け巡りました。かなり驚きました。
・FDAからのpress releaseは以下となります
FDA’s Decision to Approve New Treatment for Alzheimer’s Disease | FDA
・アルツハイマー型認知症に対する承認薬剤としては18年ぶり?の新規作用機序による薬剤となります
・ただし今回の承認は条件付き承認であり、Acceraleted Approval pathwayによるもので、臨床的効果に基づく承認ではなく、アミロイドβプラークを減少させることができるという客観的事実から、臨床的有益性を発揮することが期待できそうだということでの承認のようです。ですので、上市後の第4相試験により、臨床効果が検証され、その結果によっては販売中止もありうるようです。
・なぜ驚いたかというと、2019年3月にaducanumabの第3相試験中止のニュースが流れた際に公表された、2つの第3相試験(ENGAGE試験、EMERGE試験)の結果において、主要評価項目であるCDR-SBの変化量が、全体としてあまりすっきりせず、例えば対象となる患者群が異なるにしても、ドネペジルでのCDR-SBの変化についての結果(J Am Geriatr Soc. 2001 Dec;49(12):1590-9.)と比べても、当初6か月間の治療効果について、その差異(ドネペジルではほぼベースラインから変化していない)が明確だったからです。FDA Advisory Committeeも、11人中10人(1人は不明)がEMERGE試験の結果について否定的見解を述べたとも報道され、かなり承認の雲行きが怪しい状態でした。
・1年やそこらの期間では、Aβプラーク除去による治療効果ははっきりしないのかもしれません。少なくとも短期的に劇的によくなる、という薬ではなさそうです。
・disease modifyingという観点から、ENGAGE試験とEMERGE試験では試験期間が72週間でしたが、さらに2年、3年とみていけば、進行停止が得られるのでしょうか。
・結論が得られるのは数年後になりそうで、実際にメリットがあれば素晴らしいことと思います
・1つ夢のある方向性があるとすれば、アミロイドβの蓄積自体はアルツハイマー型認知症の発症15年以上前から既に始まっていると言われており、この超早期の段階で、健診などで脳内Aβの蓄積をスクリーニングし、aducanumabを予防的投与することにより、将来のアルツハイマー型認知症の発症が防げるとすれば、それはそれで素晴らしい方向性と言えると思います。今後の進展が期待されるところです。
-
この発想はすごい
・セガのJUDGE EYESは木村拓哉が主演でストーリーなどとてもよくできていて、YouTubeのゲーム配信に思わず見入ってしまいました。もはやゲームとは思えないような内容ですが、ゲーム中にアドデック9という夢のアルツハイマー型認知症治療薬が出現します。作用機序としては細胞の自食作用(オートファジー)を活性化してアミロイドβを分解する薬と説明されています。少し詳しい人はここでわからなくなると思うのですが、そもそもアミロイドβの蓄積は細胞外なので、細胞内蛋白分解機構である自食作用ではアミロイドβは分解できないのではないかと思ってしまいます。それともエンドサイトーシスで取り込んで分解するのでしょうか。細かいことを言えばオートファジーは非選択的な蛋白質分解機構であり、特定の蛋白質の分解を担うものではないので、アミロイドβだけを対象にするのは難しそうだし、オートファジーの中でも特定の蛋白質を対象とする機構である、選択的オートファジーについては、どうやら液滴状態の流動性が高い蛋白質については分解できるけど、アミロイドβなどの凝集体になっちゃったものは分解できないのではないか(Yamasaki et al. Mol Cell. 2020 Mar 19;77(6):1163-1175)とか、いろいろあって、結局自食作用でアドデック9の作用機序を説明するのは行き詰ってしまうわけです。ちなみにこの自食作用については2016年の大隈良典先生のノーベル生理学・医学賞が思い浮かびますが、オートファゴソーム形成の端緒となる隔離膜がどのように出現し、どのように膜成分が供給されるのかはいまのところわかっていないということで、まだまだわからないことが多い、とても面白い研究分野といえそうです。
・ALSの創薬においても、自食作用の亢進を図り治療的効果を期待する試みはいくつもあります。まずwithaferin-AはNF-κβ拮抗薬であり、自食作用を誘発することが基礎研究で言われています。また天然糖分子であるトレハロースも自食作用を活性化することが知られており、現在第2b/3相試験が行われています。また過去に第1/2相試験の行われた乳癌治療薬のタモキシフェンも自食作用を亢進させると言われています。現在第3相試験の行われているibudilast(ケタス)もその作用機序に自食作用が一部関与していると言われていますし、コルヒチンも自食作用に関連した蛋白質の誘導が関与しているようでした。他にもエストロゲン類似物質のRaloxifene、抗ヒスタミン薬のClemastineなども自食作用を亢進させることが基礎実験では言われているようです。まだまだいろいろありますが、多くの神経変性疾患において病態の中核をなすと考えられている細胞内異常蛋白質の蓄積を何とかしようという多くの挑戦が続いています。
・細胞内の異常蛋白質を除去するもう1つのメカニズムがユビキチン-プロテアソーム系による蛋白質分解機構です。こちらはオートファジーと異なり選択的な蛋白質分解除去機構になります。蛋白質が翻訳されると、シャペロンと呼ばれる蛋白質が正常な折り畳み構造になるように補助します。どうやら、生成した蛋白質のすべてが自ら正常な折り畳み構造をとることができるわけではなく、およそ10-15%ほどは正常な折り畳み構造をとるためにシャペロンの介添えを必要とするようです(Cell 90 (3): 491–500)。シャペロンの努力にも関わらず、折り畳み異常が是正できない場合には、シャペロンと折り畳み異常蛋白質の複合体がユビキチンリガーゼと呼ばれる、異常蛋白質をユビキチン化する酵素へと結合し、異常蛋白質のユビキチン化を媒介することとなります。ユビキチン化した折り畳み異常蛋白質はプロテアソームと結合し、分解が開始されます。アドデック9もユビキチンープロテアソーム経路を活性化して、リン酸化タウの凝集体(神経原線維変化)を除去するというふうにしていれば、つっこみどころがなかったかもしれません。
・今回、この記事を書くきっかけとなったのは、2021年4月29日に開催された1st Annual MDA Insight in Research Investor Summit for Neuromuscular Diseaseにおいて、バイオベンチャーのSOLA Biosciences社が興味深い報告を行ったことによります。同社が開発中のALS治療薬候補はSOL-257と呼ばれる遺伝子治療薬なのですが、遺伝子治療薬と聞いて、なんとなく、異常蛋白質の生成を阻害するmicroRNAを注入するとか、神経栄養因子を産生するプラスミドを注入するとか、そんなよくある系統の薬なのかなあと思ったら、全く新しい作用機序で、その発想に驚きました。将来への期待を感じさせるものです。
・SOLA社のホームページによると、SOL-257の作用機序は、まずアデノ随伴ウイルスベクターを用いて細胞内にTJP(Targeting J-domain Protein)遺伝子を注入し、発現したTJP蛋白質は、ターゲットとなる折り畳み異常を呈した蛋白質を特異的に認識し、結合します。さらにTJP蛋白質はJ-domainと呼ばれるシャペロン(Hsp70)に認識される領域を有しており、これにより折り畳み異常蛋白質がシャペロンに認識され、構造の正常化ないしユビキチン化へのプロセスが促進されることとなります。この発想の素晴らしい点は遺伝子発現をブロックしたり、酵素活性を変化させるなどのいろいろと副作用の起こりそうな機序を用いず、内因性機構を活用し、異常蛋白質の除去を目指している点です。ちなみにモデルマウスの実験では生存期間の延長効果が確認できたとのことで、今後第1相試験に移行することが期待されています。SOLA社のCEOは日本人の方のようです。うまくいくといいなと思います。
-
統合失調症の再発予防について
2021年05月25日
・最新のlancet psychiatry誌に2回以上のエピソードを有する(初発ではない)統合失調症ないし統合失調感情障害患者を対象とした、維持療法における介入試験について、中央値52週間程度の期間において、標準用量を維持した方がいいのか、それとも低用量(標準用量の下限の50-99%の用量)でも大丈夫なのか?を検証したメタ解析が公表されました(文献1)。少しつっこみどころがあるので、コメントしてみます
・まず、この論文のアブストラクトの結論をみて、なんとなく違和感を感じたのですが、そう感じた背景にWunderinkらの2013年の論文(文献2)や、藤田医大の岸先生の2019年の論文(文献3)が頭にあったことがあります。この2つの論文はいずれも初発精神病が対象となっている点で今回の報告(非初発)とは性質が異なりますが、その結論は重要です。
・文献2では、初発精神病後の最初の2年間で抗精神病薬の減量ないし中断を試みた群は、維持療法を行った群(無作為割付オープン試験)と比較して、最初2年間での再発率は2倍になるものの、その後さらに5年間経過観察したところ、7年予後(症状的および機能的寛解の割合)は当初減量/中断群に割り付けされた群では40.4%、維持群では17.6%であり、長期予後の観点からは減量を目指したほうがいいという結果でした。
・また文献3では、初発精神病エピソード後2年間の抗精神病薬の維持療法は、中断した場合と比較して、有意に(最初1年間で約50%程度)再発リスクを減少させるということで、抗精神病薬を維持することの重要性がわかるものでした。しかし1年間抗精神病薬を中断した患者の45.7%(18-24か月間では39.4%)は再発しなかったということで、一定の割合で抗精神病薬を中止しても再発しない患者群が存在していたということになります。今後の研究で重要なことは、どのようなケースにおいて抗精神病薬を中止可能なのかを個別に見極める指標を同定することになります
・最新のBAPガイドライン(文献4)では初発エピソード後2年間の抗精神病薬継続を推奨していますが、維持療法期間を決定する際には、患者と共同で抗精神病薬継続および中断のリスクとベネフィットについて検討し、決定することとされています。その上で、”The nature of the index episode (including speed of onset, insight, severity, and risk) can be helpful in assessing the risks associated with any future relapse”とされています。この括弧内最後のriskとは遺伝負因や一般的な再発リスクのことでしょうか?BAPガイドラインでは再発の予測因子として、服薬アドヒアランスの悪さ、男性であること、DUPが長いこと、病前の社会機能の悪さ、ベースラインでの陰性症状の重症度、物質使用障害の併存、治療者との治療関係の希薄さ、患者とその家族や介護者との間の相互作用の希薄さ、ライフイベントや家族の高感情表出(high EE)などが挙げられていますが、これら指標が果たして治療中断後にも再発リスクが高いことと関連するかどうかについては明確な結論はでていません。
・そんなわけで文献1のアブストラクトを読んで生じた違和感は、文献2や3の結論は初発エピソードについてとはいえ、今回のようにメタ解析でおしなべてしまうと、抗精神病薬を減量することにより利益を享受しうる一群の存在や、あるいは減量ないし中断可能な一群を抽出し、個別化医療を提供しようとする望ましい方向性への努力がどこかにいってしまうのではないかという懸念が浮かんだことに起因します。まずは文献1の内容をざっとまとめ、その後独自に行った解析結果では、結論がまた異なることをみてみます。
再発を繰り返す統合失調症再発予防のための抗精神病薬用量
背景
・統合失調症の維持療法期間において、急性期における抗精神病薬の継続はプラセボと比較して1年後の再発リスクを有意に減らすことが報告されている(リスク比 0.40 :Lancet 2012; 379: 2063–71.)・維持療法における最適な抗精神病薬の用量については、急性期治療で寛解に至った抗精神病薬の用量を維持することを推奨するものもあれば、効果的な最低用量の維持療法を推奨するものもあり一定しない。
・2013年以降のガイドラインで、維持療法期の抗精神病薬の用量について言及されている7つのガイドラインについて、最新のBAPガイドラインでは、維持療法期間においては、認可された範囲内の用量の抗精神病薬を継続して使用する必要があり、減量に際しては再発のリスクが高まることを考慮して、慎重かつ綿密にモニターすべきであるとしている。他6つは減量ないし低用量投与戦略を部分的に支持するとの結論になっている(例えばMausleyガイドライン2018では初発後の維持療法では慎重な減量も選択肢となっている。WFSBP2013も初発エピソード後では低用量(CP換算600mg未満)での再発予防も可能かもしれないとしている。またRANZCP2016は体重増加などの副作用発現時には変薬ないし減量を考慮すべきとなっている)
・BAPガイドラインが他6つのガイドラインと比較して、維持療法期間における減量について慎重な記載となっている理由は、Huiらの報告(Lancet Psychiatry 5:432–442.2018)の影響がある(初発エピソード後の抗精神病薬の早期(3年以内)の減量ないし中止が10年予後を悪化させていたとの報告)
・2013年から2019年までのガイドラインに影響を与えた論文にWunderinkらの報告がある(JAMA Psychiatry 2013; 70: 913–20. )。この論文では、初発精神病患者については、最初2年間で減量ないし中断を試みた場合、維持療法を行った場合と比較(無作為割付オープン試験)して、最初2年間での再発率は約2倍(減量/中断群 43%対維持群21%)になるものの、その後さらに5年間(合計7年間)オープンで経過観察したところ、7年後に症状的および機能的寛解(リカバリー)を達成した患者の割合は当初減量/中断群に割り振られた患者では40.4%、維持群では17.6%と、リカバリー率が約2倍であったことが報告された。そのため初発精神病後の減量ないし中断を目指す治療戦略は長期予後の改善を目指す上で有用かもしれないとされた。
・しかしこの論文については批判があり、有意差はないものの、ベースラインの診断が統合失調症であったものが減量/中断群では38.5%に対して維持群では52.4%、週16時間以上の労働への従事率が減量/中断群では50.8%に対して維持群では38.1%であったこと(BAPガイドラインでの批判)、オープン試験であったための結果の信頼性への問題などが指摘されている
・Uchidaら(Schizophr Bull 2011; 37: 788–99)の2009年までに公表された13試験のメタ解析において、統合失調症の再発予防における標準用量(オランザピンでは5-15mg(n=48)、クエチアピン600mg(n=52)、ジプラシドン60mgないし160mg(n=135),リスペリドンLAI 50mg/2w(n=161)、他9個の試験のうち7つは第1世代LAI(n=320:フルフェナジン decanoate、ハロペリドール decanoateなど)。残る2つは第1世代(n=23))と低用量(定義の1日用量50~100%、クエチアピン300mg(n=41)、ジプラシドン40mg(n=72)、リスペリドンLAI 25mg/2w(n=162)など)または超低用量(定義の1日用量50%未満:オランザピン1mg(n=14)を除いて全て第1世代LAI(n=172)の報告)の有効性を比較し、低用量治療は標準用量治療と比較して、入院、再発のいずれにおいても有意な差はなかったと報告した。
・一方で標準用量対超低用量については、入院、再発いずれも超低用量群が有意に増加したが、ほぼ第1世代LAIの結果であり、エントリーされた各試験の不均質性も大きいことから、結果の信頼性は低いとされている
・今回、2009年以降の第2世代抗精神病薬およびLAIの結果も含めて、統合失調症の維持療法における用量減量ないし標準用量の再発リスクや治療中断率などの比較を行った
対象と方法
・18歳以上の統合失調症ないし統合失調感情障害を対象とした24週以上無作為割付比較試験
・ベースラインで安定しており、抗精神病薬の2つの用量(標準用量ないし低用量または超低用量)で比較したもの
・初発精神病ないし治療抵抗性統合失調症は除外
・International Consensus Study of Antipsychotic Dosingが定義する急性期治療において推奨される用量の範囲内を標準用量、標準用量の下限の50-99%までを低用量、下限の50%未満を超低用量とした
・ジプラシドン、アセナピン、フルフェナジン decanoate N=6、オランザピン N=6、アリピプラゾールLAI,ハロペリドール decanoate N=2、オランザピンpamoate、ハロペリドール、propericiazine、ピモジド、スルピリド、リスペリドン N=4、クエチアピン
・主要評価項目は再発およびあらゆる理由による中断
・副次評価項目は、入院、忍容性不良による中断、PANSS変化量、体重、プロラクチン濃度、錐体外路症状得点など
・22 studies(24 trials、n=3282)。18 trialsが二重盲検、6 trialsがオープンないしsingle blind。22 studiesのうちバイアスリスクがlowと判断されたのは2つ。ハイリスクは 3つ。
・標準用量群 n=1777、低用量群 n=726、超低用量群 n=779
・参加者年齢中央値 38歳。試験期間の中央値は52週間
結果
・標準用量と比較して、低用量は再発リスクが44%有意に増加(RR=1.44 95% CI 1.10-1.87)。あらゆる理由による中断は12%有意に増加(CI 1.03-1.22)
・標準用量と比較して、第1世代低用量群は有意に再発リスクは増加(RR 2.08、95% CI 1.49-2.90 )、第2世代抗精神病薬低用量群は有意差なし(RR 1.23 CI 0.88-1.70)
・標準用量と比較して、低用量LAI群は、有意に再発リスク増加(RR 2.13 CI 1.44-3.14)、経口低用量抗精神病薬は有意差なし(RR 1.29、CI 0.96-1.72)
・標準用量と比較して、第1世代低用量群は有意にあらゆる理由による中断リスクは増加(RR 1.34、95% CI 1.11-1.63 )、第2世代抗精神病薬低用量群は有意差なし(RR 1.07 CI 0.97-1.18)
・標準用量と比較して、低用量LAI群は、あらゆる理由による中断リスクは有意差に増加(RR 1.35 CI 1.09-1.66)、経口低用量抗精神病薬は有意差なし(RR 1.08、CI 0.98-1.18)
・標準用量と比較して、超低用量では、再発リスクが72%(RR 1.72、95%CI 1.29-2.29)増加、あらゆる理由に中断リスクが31%(RR 1.31、1.11-1.54)増加。
・標準用量と比較して、第一世代超低用量群は有意に再発リスク増加(RR 1.55, 95%CI 1.06-2.28)、第二世代超低用量群においても再発リスクは有意に増加(RR 1.88, 1.22-2.90)
・標準用量と比較して、超低用量LAIは再発リスクを有意に増加( RR 1.94, 1.25-3.01 )、超低用量経口薬も再発リスクは有意に増加(RR 1.35, 1.08-1.69)
・標準用量と比較して、あらゆる理由による中断は、第一世代超低用量群では有意差なし(RR 1.14, 95%CI 0.93-1.39 )、第2世代超低用量群とは有意差あり(RR 1.38, 1.11-1.72)
・標準用量と比較して、超低用量LAIのあらゆる理由による中断率は有意差あり(RR 1.39, 1.06-1.81 )。超低用量の経口剤も有意差あり(RR 1.20, 1.04-1.38)
標準的な用量と比較して、低用量は総精神病理スコア(PANSSないしBPRS)の増加と有意に関連した(SMD 0.17、95%CI 0.03 -0.31)
入院、忍容性不良による中止、抗コリン剤の使用、錐体外路症状得点は群間で有意差なし結論
・再発歴を有する統合失調症ないし統合失調感情障害患者においては、標準用量を維持した方が、約1年後の再発率やあらゆる理由による中断率は、減量するよりも良好な可能性がある(エントリーされた試験の中央値52週、最長104週)。それ以上の長期予後についてはわからない。第2世代抗精神病薬については低用量でも標準用量と比較して再発率や中断率に有意差はでていない(数値的にはやや悪かったが)
コメント
・結果の部分で低用量第2世代抗精神病薬と標準用量との再発リスクなどの比較が、低用量第2世代抗精神病薬対標準用量第2世代抗精神病薬なのか、低用量第2世代抗精神病薬対標準用量全体なのか(おそらく前者ですが)、よくわからなかったので自分でメタ解析をしてみました。
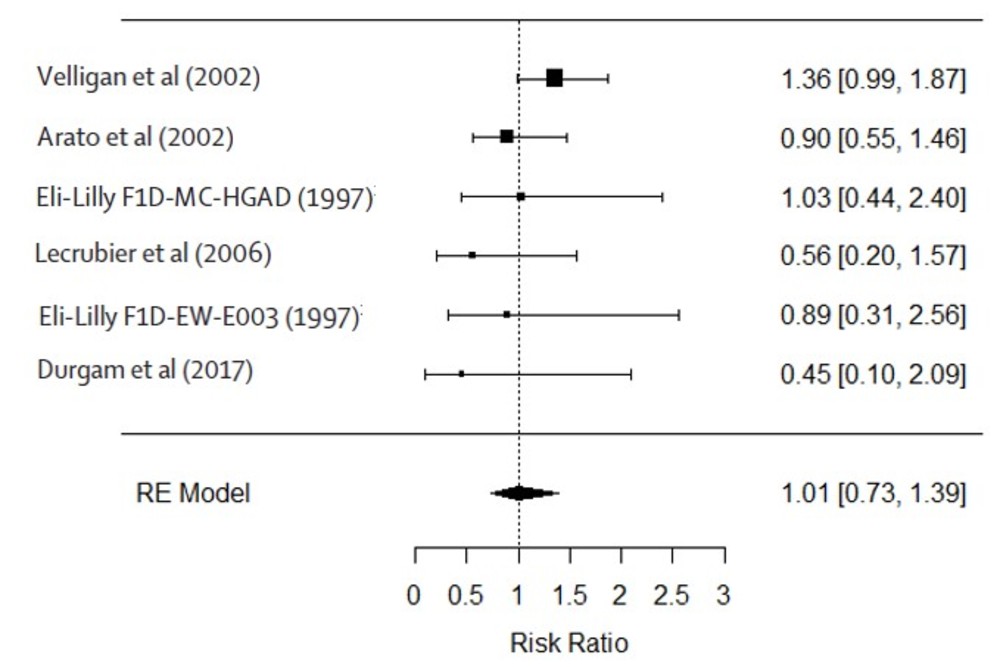
・この論文では二重盲検試験とsingle blind試験、オープン試験全ての結果をメタ解析対象として(図では二重盲検試験だけの結果も提示してありますが)いますが、とりあえず経口第2世代抗精神病薬の二重盲検試験だけを解析対象とし、標準用量対低用量について再発リスクのrisk ratioについてrandom effect modelでメタ解析をしてみます(いつものようにRのmetaforパッケージでやります)。
・コードはこんな感じです(試験のラベルはめんどくさいので入れてません。図のラベルは後付けです)
a <- c(21,2,4,5,5,48)
n1 <- c(68,31,31,16,64,88)
c <- c(23,6,12,14,9,35)
n0 <- c(67,42,83,46,64,87)
dat <- data.frame(a,n1,c,n0)
library(metafor)
dat.escalc <- escalc(measure="RR", ai=a, n1i=n1, ci=c, n2i=n0, data=dat)
res.reml <- rma.uni(yi, vi, method="REML", data=dat.escalc)
forest(res.reml, order = "prec", transf = exp, refline = 1)・そうすると、下図のように、結論は支持されず、経口第2世代抗精神病薬では、低用量でも標準用量と比較して再発リスクはそうかわらないRR=1.01(CI 0.73-1.39)となりました。どう解釈すればいいでしょうか?
文献1:Mikkel Højlund et al. Lancet Psychiatry. 2021 Jun;8(6):471-486.
文献2:JAMA Psychiatry 2013; 70: 913–20.
文献3:Kishi T. et al. Psychol Med. 2019 Apr;49(5):772-779
文献4:Re Barnes T. et al. J Psychopharmacol. 2020 Jan;34(1):3-78.




